题目内容
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、强碱性的溶液中 NO3-、I-、Na+、AlO2- |
考点:离子共存问题
专题:离子反应专题
分析:A.氯水具有强氧化性;
B.C6H5O-易与酸反应;
C.S2-与Cu2+反应;
D.碱性条件下,离子之间不发生任何反应.
B.C6H5O-易与酸反应;
C.S2-与Cu2+反应;
D.碱性条件下,离子之间不发生任何反应.
解答:
解:A.氯水具有强氧化性,与具有还原性的SO32-不能大量共存,故A错误;
B.C6H5O-易与酸反应,生成C6H5OH,故B错误;
C.S2-与Cu2+反应生成CuS沉淀,不能大量共存,故C错误;
D.碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.C6H5O-易与酸反应,生成C6H5OH,故B错误;
C.S2-与Cu2+反应生成CuS沉淀,不能大量共存,故C错误;
D.碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握题目要求以及常见离子的性质和反应类型的判断,答题时注意题给信息,难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
下列实验方法合理的是( )
| A、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱物质的量相等 |
| B、在酸、碱中和滴终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 |
| C、配制0.1mol/L的盐酸500ml,应选用的仪器有:胶头滴管、烧杯、玻璃棒、天平、500ml容量瓶 |
| D、将食用盐溶于水,然后滴入淀粉溶液,来检验食盐是否是加碘食盐 |
具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-…)的高分子有可能成为导电塑料.下列高分子中可能成为导电塑料的是( )
| A、聚乙烯 | B、聚丁二烯 |
| C、聚苯乙烯 | D、聚乙炔 |
下列实验所推出的结论不正确的是( )
| A、向漂白粉中加入稀盐酸,有无色无味气体产生,则说明漂白粉已变质 |
| B、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C、溶液里加入盐酸,有能使澄清石灰水变浑浊的无色无味的气体生成,则说明溶液中一定含有HCO3- |
| D、溶液中加入稀硝酸后,再加少量AgNO3溶液,有白色沉淀生成,则溶液中含有Cl- |
下列各溶液中,微粒的物质的量浓度关系不正确的是( )
| A、1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B、1.0mol/L NH4Cl溶液:c(NH4+)=c(Cl-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
某溶液中除了H+、OH-以外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1:1:6,下列有关该溶液判断正确的是( )
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
已建立化学平衡的某可逆反应,改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是( )
| A、此时正反应速率一定大于逆反应速率 |
| B、反应一定放出热量 |
| C、平衡时反应物的浓度一定降低 |
| D、平衡时生成物的质量分数一定增加 |
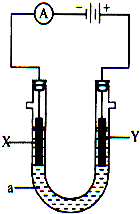 电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: