题目内容
2.某课外小组对一些金属单质和化合物的性质进行研究.(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
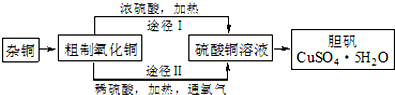
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
分析 (1)在金属活动性顺序中,铝排在铜的前面,故铝可以把氯化铜中的铜置换出来,得到的红色固体为铜,露置在空气中会与氧气、水、二氧化碳共同作用生成铜锈,其成分为碱式碳酸铜,此物质不稳定,受热易分解,根据这些知识就可以按要求写出有关反应的化学方程式;
(2)根据提供的反应物和产物及氧化还原反应可知Mn由+4价变为+2价,氧元素化合价肯定升高,根据氧化还原反应的特点来书写;
(3)①根据固体加热分析,用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却;
②由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体;途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体.
解答 解:(1)置换反应就是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,该反应为置换反应,反应为2Al+3CuCl2=3Cu+2AlCl3,即2Al+3Cu2+=2Al3++3Cu,化合反应就是由两种或两种以上的物质生成一种其他物质的化学反应,红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为化合反应,该反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
故答案为:2Al+3Cu2+=2Al3++3Cu;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O;
(3)①用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却;
故答案为:c;e;b;
②由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,
比较反应的两个途径,途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体,
故答案为:加热蒸发;过滤洗涤;产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体.
点评 本题通过常见金属及其化合物化学性质、硫酸铜晶体的制备方案设计实验,题目难度中等,考查了化学基本反应类型中的化学方程式的书写以及化学实验基本操作,注意知识的归纳和梳理以及灵活应用是关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | K+、H+、SO42-、OH- | B. | Ca2+、Na+、NO3-、CO32- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Cl-、SO42-、Cl- |
①温度计 ②烧杯 ③坩埚 ④胶头滴管 ⑤500mL容量瓶 ⑥玻璃棒⑦托盘天平.
| A. | ①②③④ | B. | ②③④⑤ | C. | ①③ | D. | ②④⑤⑥⑦ |
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N+2)}{A}$ mol | C. | $\frac{m(A-N-2)}{A}$ mol | D. | $\frac{m(A+N-2)}{A}$ mol |
 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法. 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.