题目内容
10.下列各组中的离子,能在溶液中大量共存的是( )| A. | K+、H+、SO42-、OH- | B. | Ca2+、Na+、NO3-、CO32- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Cl-、SO42-、Cl- |
分析 A.氢离子与氢氧根离子反应;
B.钙离子与碳酸根离子反应;
C.氢离子与碳酸根离子反应;
D.四种离子之间不反应,能够共存.
解答 解:A.H+、OH-之间反应,在溶液中不能大量共存,故A错误;
B.Ca2+、CO32-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故B错误;
C.H+、CO32-之间发生反应,在溶液中不能大量共存,故C错误;
D.Na+、Cl-、SO42-、Cl-之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.下列用来表示物质变化的化学用语中,错误的是( )
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol/L.对此反应速率的正确表示是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B、C、D分别表示反应的速率,其比值是3:2:1 | |
| C. | 在2min末的反应速率用B表示是0.3 mol/(L•min) | |
| D. | 在这2min内用B和C表示的速率的值都是逐渐增大的 |
5.铝和氧化铁在高温下发生的反应中,铝是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
2.某课外小组对一些金属单质和化合物的性质进行研究.
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
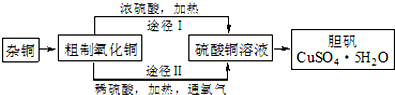
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.