题目内容
13. 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为高级酯肪酸钠能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀.家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入食盐水 中可再生.
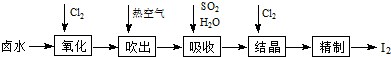
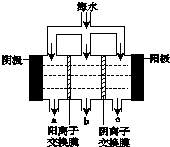
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
阳极的主要电极反应式是2Cl--2e-═Cl2↑.在阴极附近加入无色酚酞,看到的现象是阴极附近溶液变红色,有无色气体放出.淡水的出口为b(填“a”“b”或“c”).
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤.
对两种方法的评价正确的是(选填编号)ad.
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是使Fe3+完全水解为Fe(OH)3.滤渣的主要成分是Fe(OH)3、BaSO4.
分析 (1)明矾可水解生成具有吸附性的胶体;
(2)肥皂中含有高级酯肪酸钠,能与钙离子生成沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高;
c.方法一的滤液含有碳酸钠不可直接循环使用;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵.
解答 解:(1)然水在净化处理过程中加入明矾做混凝剂,因明矾水解生成具有吸附性的胶体,反应的离子方程式为Al3++3H2O?Al (OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al (OH)3(胶体)+3H+;
(2)肥皂中含有高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子,
故答案为:高级酯肪酸钠能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;食盐水;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过,所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大,在阴极附近加入无色酚酞,可以看到阴极附近溶液变红色,有无色气体放出;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出,
故答案为:2Cl--2e-═Cl2↑;阴极附近溶液变红色,有无色气体放出;b;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高,故a正确;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高,故b错误;
c.方法一的滤液含有碳酸钠不可直接循环使用,故c错误;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用,故d正确;
故选ad;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,所以滤渣的主要成分是,
故答案为:使Fe3+完全水解为Fe(OH)3;Fe(OH)3、BaSO4.
点评 本题以海水资源开发利用为载体,考查了粗盐的提纯、水的净化、硬水的软化、电解食盐水等,是对知识的综合应用,侧重于学生的分析、实验能力的考查,难度中等.

| A. | 阴离子的还原性:W>Z | B. | 单质的沸点:W>Y | ||
| C. | 最高价氧化物的水化物的酸性:Y<Z | D. | 四种元素一定都是非金属元素 |
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 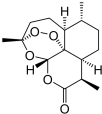 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B、C、D分别表示反应的速率,其比值是3:2:1 | |
| C. | 在2min末的反应速率用B表示是0.3 mol/(L•min) | |
| D. | 在这2min内用B和C表示的速率的值都是逐渐增大的 |
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
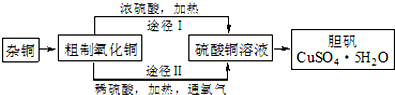
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
| A. | 玛瑙手饰所用材料的主要成分为硅酸盐 | |
| B. | 汽油去油污、焰色反应、煤的气化均属于物理变化 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 利用太阳能电池电解法将CO和H2O转化为甲酸的能量转化方式只有一种 |