题目内容
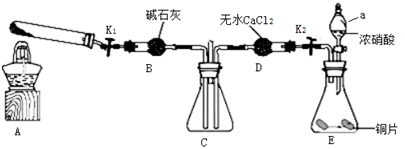
17.在8.7g二氧化锰中加入足量的浓盐酸,直至完全反应:(1)二氧化锰的物质的量;
(2)反应中生成的气体体积(标准状况);
(3)反应中作还原剂的盐酸的物质的量.
分析 (1)根据n=$\frac{m}{M}$计算二氧化锰的物质的量;
(2)发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据方程式计算生成氯气的物质的量,再根据V=nVm计算氯气体积;
(3)作还原剂的盐酸转化为氯气,根据氯原子守恒计算.
解答 解:(1)8.7g 二氧化锰的物质的量为$\frac{8.7g}{87g/mol}$=0.1mol,
答:二氧化锰的物质的量为0.1mol;
(2)设生成氯气的物质的量为n,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 1mol
0.1mol n
所以1mol:1mol=0.1mol:n
解得n=0.1mol
则标况下氯气体积为0.1mol×22.4L/mol=2.24L
答:标况下生成氯气的体积为2.24L.
(3)作还原剂的盐酸转化为氯气,根据氯原子守恒,反应中作还原剂的盐酸的物质的量为0.1mol×2=0.2mol,
答:反应中作还原剂的盐酸的物质的量为0.2mol.
点评 本题考查化学方程式计算、氧化还原反应计算、物质的量有关计算等,题目贴近教材,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
8.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 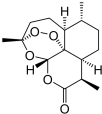 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
5.铝和氧化铁在高温下发生的反应中,铝是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
12.在Fe+CuSO4═FeSO4+Cu反应中,CuSO4是氧化剂;Fe是还原剂;Fe元素被氧化;Cu元素被还原;FeSO4是氧化产物;Cu是还原产物,具有氧化性的是CuSO4;具有还原性的是Fe.
2.某课外小组对一些金属单质和化合物的性质进行研究.
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
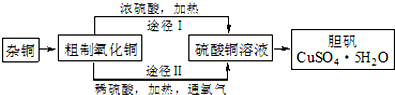
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.
该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放
在b上,不能直接放在桌面上.
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
9.下列各组物质中,所含分子数相等的是( )
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
6.标准状况下呈液态的物质为( )
| A. | Fe | B. | N2 | C. | CH3CH2OH | D. | CO |
12.配制100mL0.5mol/LNaOH溶液的操作有:①计算 ②冷却 ③洗涤 ④溶解 ⑤转移 ⑥称量 ⑦定容,次序正确的是( )
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |