题目内容
短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是地壳中含量最多的元素,W是所处周期中金属性最强的元素,M的负一价离子与Z的某种氢化物Q含有相同的电子数.
(1)X、Z、W形成的化合物中含有的化学键类型为 ;
(2)Q分子的电子式为 ;
(3)A是由Y、Z、W三种元素共同构成的常见化合物,其水溶液呈碱性,写出溶液中所有
离子的浓度由大到小的顺序 ;
(4)由X、Y组成的燃料被广泛的应用于原电池领域.由X、Y组成的原子个数比为1:3的化合物与Z的单质在KOH作电解质时可构成一种原电池,请写出该原电池负极电极反应方程式 ;
(5)用KMnO4溶液可以通过滴定来测定X2Y2Z4溶液的物质的量浓度.向25.00mL的X2Y2Z4溶液中加入5.00mL0.5mol/L酸性KMnO4溶液恰好完全反应,得到YZ2和Mn2+,则请写出该反应的离子方程式 ;
此X2Y2Z4溶液的物质的量浓度是 mol/L.
(1)X、Z、W形成的化合物中含有的化学键类型为
(2)Q分子的电子式为
(3)A是由Y、Z、W三种元素共同构成的常见化合物,其水溶液呈碱性,写出溶液中所有
离子的浓度由大到小的顺序
(4)由X、Y组成的燃料被广泛的应用于原电池领域.由X、Y组成的原子个数比为1:3的化合物与Z的单质在KOH作电解质时可构成一种原电池,请写出该原电池负极电极反应方程式
(5)用KMnO4溶液可以通过滴定来测定X2Y2Z4溶液的物质的量浓度.向25.00mL的X2Y2Z4溶液中加入5.00mL0.5mol/L酸性KMnO4溶液恰好完全反应,得到YZ2和Mn2+,则请写出该反应的离子方程式
此X2Y2Z4溶液的物质的量浓度是
考点:位置结构性质的相互关系应用,化学电源新型电池
专题:元素周期律与元素周期表专题,电化学专题
分析:短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,故X为H,Y是形成化合物种类最多的元素,故Y为C,Z是地壳中含量最多的元素,故Z为O,W是同周期中金属性最强的元素,故W为Na,M的负一价离子与Z的某种氢化物分子(应为H2O2)含有相同的电子数即18个,故M为Cl,
据此回答.
据此回答.
解答:
解:短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,故X为H,Y是形成化合物种类最多的元素,故Y为C,Z是地壳中含量最多的元素,故Z为O,W是同周期中金属性最强的元素,故W为Na,M的负一价离子与Z的某种氢化物分子(应为H2O2)含有相同的电子数即18个,故M为Cl,
(1)X、Z、W形成的化合物为NaOH,其中含有的化学键类型为离子键和共价键,故答案为:离子键、共价键;
(2)H2O2的电子式为: ;故答案为:
;故答案为: ;
;
(3)由Y、Z、W三元素共同构成的化合物为碳酸钠,CO32-水解显碱性,方程式为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-,溶液中各个离子浓度的关系,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(4)由X、Y组成的原子个数比为1:3的化合物为C2H6,与O2构成燃料电池,在KOH作电解质时,负极反应为 2C2H6+36OH--28e-=4CO32-+24H2O,故答案为:2C2H6+36OH--28e-=4CO32-+24H2O;
(4),根据题意,X2Y2Z4为H2C2O4,反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出离子方程式为:2MnO4-+5 H2C2O4+6H+═10CO2↑+2 Mn2++8H2O;向25.00mL 的H2C2O4溶液中加入5.00mL 0.50mol/L酸性KMnO4溶液恰好完全反应,则C元素由+3价升高到+4价,Mn元素由+7价降低为+2,设H2C2O4溶液的物质的量浓度为x,由电子守恒可知,0.025L×x×2×(4-3)=0.005L×0.5mol/L×(7-2),
解得x=0.25mol/L,
故答案为:2MnO4-+5 H2C2O4+6H+═10CO2↑+2 Mn2++8H2O、0.25.
(1)X、Z、W形成的化合物为NaOH,其中含有的化学键类型为离子键和共价键,故答案为:离子键、共价键;
(2)H2O2的电子式为:
 ;故答案为:
;故答案为: ;
;(3)由Y、Z、W三元素共同构成的化合物为碳酸钠,CO32-水解显碱性,方程式为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-,溶液中各个离子浓度的关系,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(4)由X、Y组成的原子个数比为1:3的化合物为C2H6,与O2构成燃料电池,在KOH作电解质时,负极反应为 2C2H6+36OH--28e-=4CO32-+24H2O,故答案为:2C2H6+36OH--28e-=4CO32-+24H2O;
(4),根据题意,X2Y2Z4为H2C2O4,反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出离子方程式为:2MnO4-+5 H2C2O4+6H+═10CO2↑+2 Mn2++8H2O;向25.00mL 的H2C2O4溶液中加入5.00mL 0.50mol/L酸性KMnO4溶液恰好完全反应,则C元素由+3价升高到+4价,Mn元素由+7价降低为+2,设H2C2O4溶液的物质的量浓度为x,由电子守恒可知,0.025L×x×2×(4-3)=0.005L×0.5mol/L×(7-2),
解得x=0.25mol/L,
故答案为:2MnO4-+5 H2C2O4+6H+═10CO2↑+2 Mn2++8H2O、0.25.
点评:本题是原子结构知识和化学平衡知识相结合的一道综合题目,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
在温度、容积相同的3个密闭容器中,按下表投入反应物.发生反应:H2(g)+I2(g)═2HI(g)△H=14.9kJ?mol-1,在恒温、恒容条件下,测得反应达到平衡时的有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2 1mol I2 | 2mol HI | 4mol HI |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akg | 吸收bkg | 吸收ckg |
| 反应物转化率 | α1 | α2 | α3 |
| A、2α1=α3 |
| B、α1+α2=1 |
| C、c1=c2=c3 |
| D、a+b=14.9 |
某种混合气体,可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化,经干燥后再通过足量的Na2O2固体,气体体积减少,最后通过灼热的铜网,经充分反应后,气体体积又减少,但还有剩余气体,以下对混合气体区分的判断,正确的是( )
| A、一定没有N2,CO和HCl中至少有一种 |
| B、一定没有N2,CO和HCl都有 |
| C、一定有N2,CO和HCl中至少有一种 |
| D、一定有N2和HCl,肯定没有CO |
往下列溶液中,通入足量CO2气体,最终能产生白色沉淀的是( )
| A、饱和Na2CO3溶液 |
| B、澄清石灰水 |
| C、CaCl2溶液 |
| D、盐酸 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| D、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
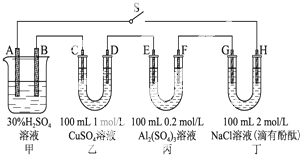 如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
 (1)下列实验操作中,错误的是
(1)下列实验操作中,错误的是
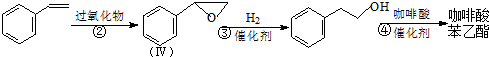
 的芳香化合物共有5种
的芳香化合物共有5种 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为