题目内容
4.正常人体内低密度脂蛋白胆固醇的含量范围为2.84~3.10μmol•L-1,严,人体内该物质含量升高易导致动脉粥样硬化.你认为这里的μmol•L-1表示的是低密度脂蛋白胆固醇的( )| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
分析 依据物质的量浓度概念及单位解答.
解答 解:溶质(用字母B表示)的物质的量浓度是指单位体积溶液中所含溶质B的物质的量,用符号cB表示,单位为:mol/L,依据题意:正常人体内低密度脂蛋白胆固醇的含量范围为2.84~3.10μmol•L-1,可知低密度脂蛋白胆固醇的含量范围为1L血液中含有胆固醇为2.84~3.10μmol,所以这里的μmol•L-1表示的是低密度脂蛋白胆固醇的物质的量浓度,
故选:D.
点评 本题考查了物质的量浓度概念的理解,明确物质的量浓度含义及单位是解题关键,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
15.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp2杂化 | |
| C. | 丙烯分子中最多有7个原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
12.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
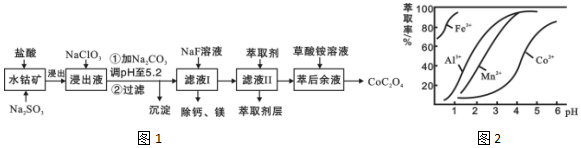
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色)(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为$\frac{36.75cV}{m}$%.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色)(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为$\frac{36.75cV}{m}$%.
9.某化学式为C5H12O的有机物,既能跟Na反应,又能在Cu催化下与O2反应,则满足该条件的化合物有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
5. 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
3.在10℃和2×105 Pa的条件下,反应aA(g)?dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变).表列出了不同压强下平衡时物质D的浓度.
根据表中数据,回答下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是左,理由是D浓度增大的倍数小于压强增大的倍数.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡移动方向是右,理由是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是左,理由是D浓度增大的倍数小于压强增大的倍数.
(2)压强从5×105 Pa增加到1×106 Pa时,平衡移动方向是右,理由是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
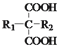 $\stackrel{△}{→}$
$\stackrel{△}{→}$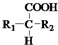 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)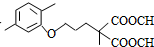 $\stackrel{△}{→}$
$\stackrel{△}{→}$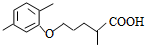 +CO2↑.
+CO2↑.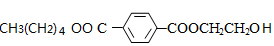 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是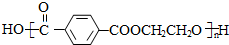 .
.