题目内容
下列说法正确的是( )
| A、根据类推思想,氯化铝溶液蒸干后灼烧,最后得到氧化铝,则硫酸铝也一样 |
| B、一定条件下的可逆反应2NO2?2NO+O2,若混合气体的颜色不变,则该反应已达平衡状态 |
| C、HCl和NaOH反应的中和热为△H,则H2SO4和Ca(OH)2反应的中和热为2△H |
| D、在NH4Cl水溶液中,为使c(NH4+)=c(Cl-),理论上可通入氨气或氯化氢气体实现 |
考点:盐类水解的应用,反应热和焓变,化学平衡状态的判断
专题:基本概念与基本理论
分析:A.硫酸没有挥发性;
B.当反应前后改变的量不变时,可能反应达到平衡状态;
C.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;
D.氯化铵溶液中铵根离子水解导致c(NH4+)<c(Cl-),要使c(NH4+)=c(Cl-),应该通入部分氨气.
B.当反应前后改变的量不变时,可能反应达到平衡状态;
C.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;
D.氯化铵溶液中铵根离子水解导致c(NH4+)<c(Cl-),要使c(NH4+)=c(Cl-),应该通入部分氨气.
解答:
解:A.硫酸没有挥发性,所以蒸干灼烧硫酸铝溶液时最终得到的固体是硫酸铝,故A错误;
B.当反应前后改变的量不变时,可能反应达到平衡状态,二氧化氮是红棕色气体、NO是无色气体,当混合气体的颜色不变,则该反应已达平衡状态,故B正确;
C.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,故C错误;
D.氯化铵溶液中铵根离子水解导致c(NH4+)<c(Cl-),要使c(NH4+)=c(Cl-),应该加入部分氨气,如果通入HCl气体,虽然抑制铵根离子水解,但溶液中氯离子浓度增大,故D错误;
故选B.
B.当反应前后改变的量不变时,可能反应达到平衡状态,二氧化氮是红棕色气体、NO是无色气体,当混合气体的颜色不变,则该反应已达平衡状态,故B正确;
C.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,故C错误;
D.氯化铵溶液中铵根离子水解导致c(NH4+)<c(Cl-),要使c(NH4+)=c(Cl-),应该加入部分氨气,如果通入HCl气体,虽然抑制铵根离子水解,但溶液中氯离子浓度增大,故D错误;
故选B.
点评:本题考查较综合,涉及盐类水解、中和热、化学平衡状态的判断等知识点,根据盐的特点、中和热的概念、平衡状态的判断依据等知识点解答,注意C中中和热与酸或碱的元数无关,注意加热蒸干灼烧氯化铝和硫酸铝溶液得到固体不同的原因,为易错点.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、2.3g金属钠变成钠离子时失去的电子数目为0.2NA |
| B、通常状况下,22.4L氢气中所含分子数目为NA |
| C、1molNH3中所含的电子数为10NA |
| D、1 mol/L的NaCl溶液中含NA个钠离子 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH- |
| C、电池工作时,OH-向MnO2反应的方向移动 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
加拿大天文学家观察到星际空间存在有链分子HC9N,其结构简式为 ,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )
,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )
 ,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )
,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )| A、属于不饱和链烃 |
| B、该分子中所有原子都满足8电子结构 |
| C、1mol该分子在一定条件下可与10molH2发生加成反应 |
| D、该分子可以由乙炔和含氮化合物加聚而成 |
下列各组物质均可用分液漏斗分离的一组是( )
①酒精和水 ②溴乙烷和水 ③乙酸和乙酸乙酯 ④甘油和水
⑤溴苯和溴 ⑥硝基苯和稀H2SO4 ⑦植物油和食盐水 ⑧乙酸乙酯和碳酸钠溶液.
①酒精和水 ②溴乙烷和水 ③乙酸和乙酸乙酯 ④甘油和水
⑤溴苯和溴 ⑥硝基苯和稀H2SO4 ⑦植物油和食盐水 ⑧乙酸乙酯和碳酸钠溶液.
| A、①②③④ | B、②④⑥⑦ |
| C、③④⑤ | D、②⑥⑦⑧ |
下列说法正确的是( )
| A、对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量 |
| B、任何放热反应在常温条件下一定能发生反应 |
| C、形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应 |
| D、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
 如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:
如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题: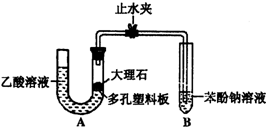 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.