题目内容
18.一定条件下,在容积固定的某密闭容器中发生反应N2+3H2?2NH3.在10s内N2的浓度由5mol/L降至4mol/L,下列说法正确的是( )| A. | 用NH3表示的化学反应速率为0.1 mol/(L•s) | |
| B. | 反应足够长时间,N2、H2中至少有一种物质浓度降为零 | |
| C. | 增加H2的浓度或降低温度都会加快该反应的速率 | |
| D. | 使用合适的催化剂,可以加快该反应的速率 |
分析 A.根据v=$\frac{△c}{△t}$计算出氮气的速率,再根据速率之比等于计量数之比求得氨气的反应速率;
B.该反应为可逆反应,根据可逆反应的特点,反应物的浓度不可能降为零.
C.降低温度,反应速率减小;
D.催化剂可降低反应的活化能,增大反应速率.
解答 解:A.根据v=$\frac{△c}{△t}$计算出氮气的速率为$\frac{5mol-4mol}{10s}$=0.1 mol/(L•s),再根据速率之比等于计量数之比求得氨气的反应速率为2×0.1 mol/(L•s)=0.2mol/(L•s),故A错误;
B.该反应为可逆反应,根据可逆反应的特点,反应物的浓度不可能降为零的,故B错误;
C.降低温度,活化分子百分数减小,反应速率减小,故C错误;
D.如用正催化剂,催化剂可降低反应的活化能,增大反应速率,故D正确.
故选D.
点评 本题主要考查了反应速率的计算、影响平衡移动的因素、及可逆反应的特征等知识点,侧重于学生的分析能力的考查,难度不大,解题时注意基础知识的灵活运用.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
9.某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
10.已知维生素A的结构简式如图,关于它的叙述不正确的是( )


| A. | 1mol维生素A在氧气中燃烧,一定能生成20mol CO2 | |
| B. | 维生素A能发生酯化反应 | |
| C. | 1mol维生素A在催化剂作用下最多能与5mol H2发生加成反应 | |
| D. | 维生素A能使酸性KMnO4溶液褪色 |
10.没食子酸丙酯(简称PG)是脂溶性食品抗氧化剂,其结构简式如图:下列有关说法不正确的是( )
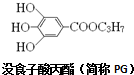

| A. | 没食子酸的分子式为C10H13O5 | B. | 1molPG可与4molNaOH反应 | ||
| C. | PG中的基团-C3H7有两种结构 | D. | PG有还原性,易被氧化 |
7.已知甲、乙、丙、X是中学化学中四种常见的物质,其转化关系如图所示.则甲和X不可能是( )
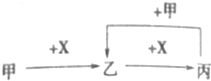
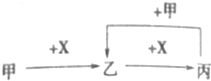
| A. | 甲为CO2,X为NaOH溶液 | B. | 甲为NH3,X为O2 | ||
| C. | 甲为Si,X为O2 | D. | 甲为NaAlO2,X为HCl溶液 |
8.下列有关化学用语正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子结构示意图: | |
| D. | MgCl2的电子式: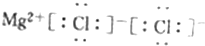 |
