题目内容
11.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其最内层电子数的3倍,A、B、D、E这四种元素,每一种都能与C元素形成两种或两种以上的化合物.请回答下列问题:(1)C和E两元素相比较,非金属性较强的是氧(填元素名称),可以验证该结论的是cd (填写编号)
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的原子的最外层电子数
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易程度
(2)盐X的水溶液呈酸性(填酸、碱、中).原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示)
(3)C、D两元素能形成原子个数比为1:1的化合物,则该化合物的电子式为:
 .
.(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为OH-+HS-=H2O+S2-.
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素是原子半径最小的原子,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;E元素的最外层电子数是其最内层电子数的3倍,最外层最多含有8个电子,则E最外层含有6个电子,结合原子序数大小可知E为S;D与A同主族,且与E同周期,则D为Na元素;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素是原子半径最小的原子,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;E元素的最外层电子数是其最内层电子数的3倍,最外层最多含有8个电子,则E最外层含有6个电子,结合原子序数大小可知E为S;D与A同主族,且与E同周期,则D为Na元素;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,
(1)氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性等来判断,厄尔氢化物沸点、最外层电子式都不能比较非金属性强弱,故Ab错误、cd正确,
故答案为:氧; cd;
(2)X为氨气与硝酸反应生成的硝酸铵,铵根离子水解:NH4++H2O?NH3•H2O+H+,则硝酸铵溶液呈酸性,
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(3)C、D两元素形成的原子个数比为1:1的化合物为Na2O2,过氧化钠我离子化合物,其电子式为 ,
,
故答案为: ;
;
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-离子,甲与乙反应的离子方程式为:OH-+HS-=H2O+S2-,
故答案为:OH-+HS-=H2O+S2-.
点评 本题考查位置结构性质的应用,为高考常见题型,侧重于学生的分析能力的考查,掌握元素单质化合物的性质来推断元素是解答本题的关键,学生只要熟悉常见的化合物即可解答,题目难度中等.

 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
 .
.
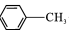 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$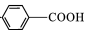
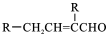
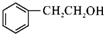 ,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为
,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为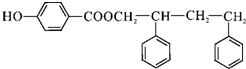 ;
; ;
;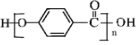 ;
;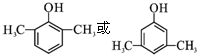 .
.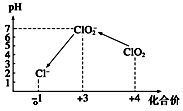 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
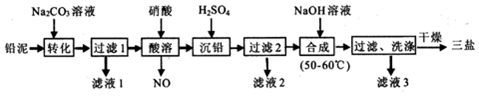


 ,乙物质中含有的化学键是离子键、共价键;
,乙物质中含有的化学键是离子键、共价键; ,
,