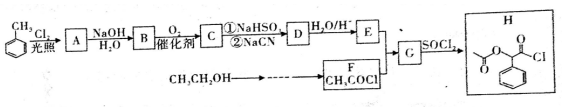
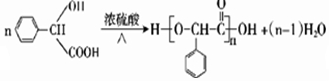
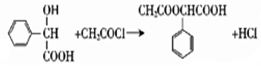
题目内容
6. 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.(1)在进行饮用水消毒时,ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,据此说明ClO2具有氧化性.
(2)科学家研究出的一种新的制备ClO2的方法,在酸性溶液中用草酸(H2C2O4)还原氯酸钠(NaClO3),请完成该离子反应方程式并配平:H2C2O4+2ClO3-+2H+=2CO2↑+2ClO2↑+2H2O.
(3)液氯也常用作自来水消毒,则相同物质的量的ClO2的消毒效率是Cl2后者的2.5倍.(消毒效率指单位物质的量得电子数)
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
操作Ⅱ:加入一定量的Na2S2O3溶液.(已知:2S2O32-+I2═S4O62-+2I-)
操作Ⅲ:加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是2ClO2+2I-═2ClO2+I2.
②确定操作Ⅱ完全反应的现象是蓝色恰好消失.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+═Cl-+2I2+2H2O.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是0.675mg•L-1.
分析 (1)结合氧化还原反应中化合价升降相等,判断ClO2中Cl元素化合价变化,元素化合价升高表现还原性,元素化合价降低表现氧化性;
(2)酸性溶液中用草酸(H2C2O4)还原氯酸钠(NaClO3),发生氧化还原反应,遵循电子、电荷守恒;
(3)设物质的量均为1mol,则ClO2、Cl2的转化为Cl-得到电子分别为5mol、2mol;
(4)①操作Ⅰ中ClO2与KI发生氧化还原反应;
②操作Ⅱ:加入一定量的Na2S2O3溶液,发生2S2O32-+I2═S4O62-+2I-,蓝色消失;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)反应中Fe元素、Mn元素化合价升高,根据化合价升降相等,ClO2中Cl元素化合价降低,表现氧化性,
故答案为:氧化;
(2)酸性溶液中用草酸(H2C2O4)还原氯酸钠(NaClO3),离子反应为H2C2O4+2ClO3-+2H+=2CO2↑+2ClO2↑+2H2O,遵循电荷、电子守恒,
故答案为:H2C2O4+2ClO3-+2H+=2CO2↑+2ClO2↑+2H2O;
(3)设物质的量均为1mol,则ClO2、Cl2的转化为Cl-得到电子分别为5mol、2mol,则相同物质的量的ClO2的消毒效率是Cl2的$\frac{5mol}{2mol}$=2.5倍,
故答案为:2.5;
(4)①操作Ⅰ中ClO2与KI发生氧化还原反应,离子反应为2ClO2+2I-═2ClO2+I2,
故答案为:2ClO2+2I-═2ClO2+I2;
②操作Ⅱ:加入一定量的Na2S2O3溶液,发生2S2O32-+I2═S4O62-+2I-,蓝色消失,则确定操作Ⅱ完全反应的现象是蓝色恰好消失,
故答案为:蓝色恰好消失;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~I-~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题考查物质含量的测定,为高频考点,把握发生的氧化还原反应、反应的计算为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
 .
.

 .
. .
.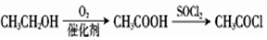 .
.
 .
. .
.

 ;
;
