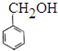
题目内容
12.下列叙述中正确的是( )
| A. | 图①中正极附近溶液pH减小 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②正极反应是O2+2H2O+4e-═4OH- | |
| D. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
分析 图①为铜锌原电池,锌为负极,被氧化,铜为正极,正极发生还原反应,图②为铁-铜原电池,铁为负极,被氧化,铜为正极,以此解答该题.
解答 解:A.图①中铜为正极,发生Cu2++2e-=Cu,Cu2+浓度减小,则溶液pH增大,故A错误;
B.原电池工作时,电子从负极经导线流向正极,阴离子向负极移动,阳离子向正极移动,故B错误;
C.图②为铁-铜原电池,铁为负极,铜为正极,正极上2H++2e-═H2↑,故C错误;
D.图②中铁为负极,负极发生氧化反应,为Fe-2e-═Fe2+,所以加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成,故D正确.
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,注意把握常见原电池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
3.下列叙述中,正确的是( )
| A. | 石油、煤、氢气都属于化石燃料 | B. | 化合反应都是放热反应 | ||
| C. | 分解反应都是吸热反应 | D. | 风能可以转化为电能 |
7.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 39g K 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 含4 molHCl的浓盐酸和足量MnO2加热反应可生成NA个Cl2分子 | |
| C. | 标准状况下,22.4L 氟化氢中含2NA个原子 | |
| D. | 2mol单质Cu与足量高温硫蒸气完全反应,失去2NA个电子 |
17.已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是( )
| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
4.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-aKJ/mol,在其他条件不变的情况下,下列说法正确的是( )
| A. | 1mol CO(g)和1molH2O(g)充分反应,放出的热量为aKJ | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,速率加快,反应放出的热量不变 | |
| D. | 若将该反应设计为原电池,反应放出的热量不变 |
1.下列关于原电池的叙述正确的是( )
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 任何化学反应只要是自发进行的放热反应都可以被设计成原电池 | |
| C. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| D. | 原电池是化学能转变为电能的装置,为外界提供电能 |
2.短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z 的单质能溶于 W 的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
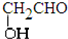 ③CH3CH2CH2CH3和
③CH3CH2CH2CH3和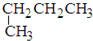
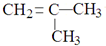 ⑥
⑥ 和
和