题目内容
6.下列叙述正确的是( )| A. | 100 mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molCl2中充分燃烧,反应时转移6.02×1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500 mL 18.4 mol•L-1的硫酸中,产生H2比11.2L多 |
分析 A、碳酸根离子是弱离子,水溶液中分步水解;
B、氯气与铁反应生成氯化铁,1mol的氯气转移2mol的电子,所以0.05molC12转移电子的物质的量为0.05×2=0.1mol;
C、将4gNaOH溶于100g蒸馏水,溶液体积不明确;
D、常温下铝与浓硫酸发生钝化.
解答 解:A、碳酸根离子是弱离子,水溶液中水解,所以100mL1mol/L的Na2CO3溶液中含有CO32-小于6.02×1022个,故A错误;
B、氯气与铁反应生成氯化铁,1mol的氯气转移2mol的电子,所以0.05molC12转移电子的物质的量为0.05×2=0.1mol,所以反应时转移6.02x1022个电子,故B正确;
C、溶液体积不明确,故所得氢氧化钠溶液的浓度无法计算,故C错误;
D、常温下铝与浓硫酸发生钝化,表面形成一薄层致密氧化物薄膜,不产生氢气,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的性质是解题关键,学生注意18.4mol•L-1的硫酸是浓硫酸,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
16.元素周期表和元素周期律是学习化学的重要工具,可以帮助我们推测元素及其化合物的结构和性质,对工农业生产具有一定的指导意义.下表是元素周期表的部分片段(2、3周期).
根据上表回答下列问题(请使用具体元素符号或化学式,不能用编号回答问题):
(1)8种元素中,金属性最强的是Na,化学性质最不活泼的是Ar
(2)由①、④与氧三种元素形成的化合物,其水溶液洗涤油污物品时,用热的水溶液去油污的效果比较好.请解释“用热的水溶液去油污的效果比较好”的原因加热促进纯碱水解,使OH-浓度增大,增强了去油污的能力
(3)④元素形成的多种同素异形体,有广泛的用途.请写出其中任意两种同素异形体的名称:金刚石 和石墨
(4)写出①的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物反应的化学方程式NaOH+HNO3=NaNO3+H2O
(5)某同学做同周期元素性质递变规律实验时,设计了如下实验并记录了有关实验现象.
请你根据上表得出实验结论:金属性:Na>Mg>Al;若比较⑥与⑦的单质的活泼性,请写出实验方案向Na2S或H2S溶液中通入Cl2,若观察到有淡黄色混浊,则活泼性Cl2强于S(或HCl比H2S稳定).
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
(1)8种元素中,金属性最强的是Na,化学性质最不活泼的是Ar
(2)由①、④与氧三种元素形成的化合物,其水溶液洗涤油污物品时,用热的水溶液去油污的效果比较好.请解释“用热的水溶液去油污的效果比较好”的原因加热促进纯碱水解,使OH-浓度增大,增强了去油污的能力
(3)④元素形成的多种同素异形体,有广泛的用途.请写出其中任意两种同素异形体的名称:金刚石 和石墨
(4)写出①的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物反应的化学方程式NaOH+HNO3=NaNO3+H2O
(5)某同学做同周期元素性质递变规律实验时,设计了如下实验并记录了有关实验现象.
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液 的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象, 再将水加热 | 开始无现象,加热后有气体产生 |
| C、将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D、将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
14.下列反应中,HNO3既表现氧化性又表现酸性的是( )
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
1.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是 ( )
| A. | 含有NH4+、Cl-、H+、OH-离子的溶液中,一定有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
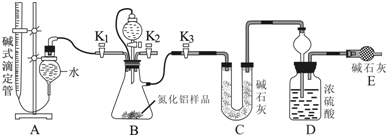
11.如图中的实验方案,能达到实验目的是( )
| 选项 | A | B | C | D |
| 实验 方案 | 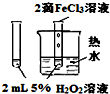 | 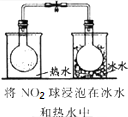 | 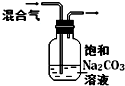 | 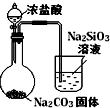 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡2NO2→N2O4的影响 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
13.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
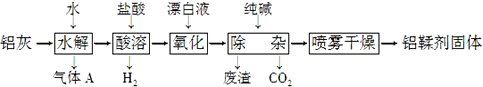
下列说法错误的是( )

下列说法错误的是( )
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
 可简写为
可简写为 .现有某化合物w的分子结构可表示为
.现有某化合物w的分子结构可表示为 .
.