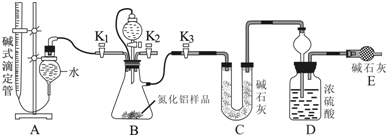
题目内容
2.在下列说法中,正确的是( )| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 若反应物所具有的总能量小于生成物所具有的总能量,则发生的是放热反应 | |
| C. | 稀H2SO4溶液与稀Ba(OH)2溶液反应生成lmol H2O时放出的热量叫中和热 | |
| D. | 1molH2与0.5molO2反应放出的热量就是H2的燃烧热 |
分析 A.热化学方程式的化学计量数表示物质的量,不表示分子个数;
B.反应物所具有的总能量小于生成物所具有的总能量,该反应为吸热反应;
C.该反应中除了生成水,还生成了硫酸钡沉淀;
D.燃烧热中生成氧化物必须为稳定氧化物,该反应中没有指出水的状态.
解答 解:A.热化学方程式的化学计量数表示物质的量,可以是整数也可以是分数,故A正确;
B.若反应物所具有的总能量小于生成物所具有的总能量,反应物转化成生成物需要吸收热量,即发生的是吸热反应,故B错误;
C.稀H2SO4溶液与稀Ba(OH)2溶液反应生成硫酸钡沉淀和水,则该反应生成lmol H2O时放出的热量偏大,不是中和热,故C错误;
D.1molH2与0.5molO2反应生成液态水放出的热量是H2的燃烧热,若生成的是气态水,则不是燃烧热,故D错误;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确中和热、燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
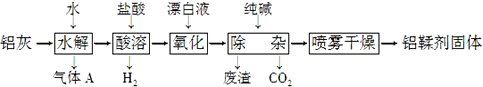
下列说法错误的是( )

下列说法错误的是( )
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
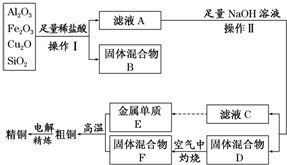
17.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如图:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),
依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸,试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),
依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸,试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
7. 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | Cu | CuO | Cu(OH)2 |
| ② | CH3CH2OH | CH3CHO | CH2═CH2 |
| ③ | Na2CO3 | NaOH | NaHCO3 |
| ④ | CaCO3 | CaO | Ca(OH)2 |
| A. | ②③ | B. | ③④ | C. | ②④ | D. | ①② |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | PH=1的溶液中:Na+、ClO-、SO42-、I- | |
| B. | 由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、SO32-、NO3 | |
| D. | 无色透明的溶液中:K+、Cu2+、SO42-、Na+ |
11.下列晶体中含有非极性共价键的离子晶体是( )
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚.
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚.
| A. | ①②④⑥ | B. | ①③ | C. | ②④⑤⑥ | D. | ③⑤ |
12.下列说法中,正确的是( )
| A. | SO2的摩尔质量是64g | |
| B. | 标准状况下18g水的体积是22.4L | |
| C. | 在标准状况下,20 mLNH3 与60 mLO2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |