题目内容
11.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )| A. | 氯化钠可用作调味剂 | |
| B. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾可用作净水剂 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
分析 A.氯化钠具有咸味;
B.过氧化钠与水、二氧化碳反应生成氧气;
C.明矾电离产生铝离子水解生成氢氧化铝,具有吸附性;
D.FeCl3溶液中的铁离子具有较强的氧化性能与Cu反应.
解答 解:A.氯化钠具有咸味,可用作调味剂,故A正确;
B.过氧化钠与水、二氧化碳反应生成氧气,常用于潜水艇或呼吸面具的供氧剂,氧化钠不具有此性质,故B错误;
C.明矾电离产生铝离子水解生成氢氧化铝,具有吸附性,可以吸收水中杂质,具有是净水作用,故C正确;
D.FeCl3溶液中的铁离子具有较强的氧化性能与Cu反应,FeCl3溶液可用于刻制印刷铜电路板,反应为:2FeCl3+Cu=2FeCl2+CuCl2,故D正确.
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.某碳酸钠样品中可能含有硫酸钠、氯化钠等杂质,为确定其所含杂质的具体成分,提出假设和具体实验方案.实验所需玻璃仪器任选,可供药品有:稀硫酸、稀硝酸、稀盐酸、NaOH稀溶液、AgNO3等溶液、BaCl2溶液、Ba(NO3)2溶液及蒸馏水等.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀硝酸 | 有气体产生,说明样品中含有Na2CO3 |
| ② | 向试管中加入足量Ba(NO3)2溶液 | 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4 |
| ③ | 若②操作无沉淀,则向试管中加入0.1mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1mol•L-1AgNO3溶液 | 有沉淀产生,则含NaCl;无沉淀产生,则不含NaCl |
2.下列分析问题的因果关系正确的是( )
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
6.下列物质长久放置在空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A. | 常温下,铝遇冷浓硝酸钝化 | B. | 浓盐酸的质量减轻 | ||
| C. | 澄清的石灰水变浑浊 | D. | 氢氧化钠固体发生潮解 |
16.在由水电离出来的c (H+)=1×10-13mol•L-1溶液中,下列离子可能大量共存的是( )
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、Na+、SO42-、MnO4- | ||
| C. | K+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
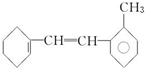 有机物结构简式如下:
有机物结构简式如下: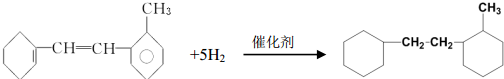 .
.