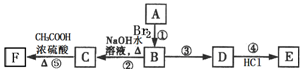
题目内容
16.(1)检验C12的实验方法:湿润的淀粉KI试纸(2)C1O2常用于水的净化,工业上可用Cl2氧化NaClO2 溶液制取ClO2.写出该反应的离子方程式Cl2+2ClO2 -=2Cl-+2ClO2-,并标出电子转移的方向和数目:
 .
.
分析 (1)检验C12的实验方法用淀粉KI试纸;
(2)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
解答 解:(1)检验C12的实验方法用淀粉KI试纸,如果湿润的淀粉KI试纸变蓝,说明氯气的存在,故答案为:湿润的淀粉KI试纸;
(2)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式为:Cl2+2ClO2 -=2Cl-+2ClO2-、电子转移的方向和数目表示为 ,
,
故答案为:Cl2+2ClO2 -=2Cl-+2ClO2-; .
.
点评 本题考查化学实验方案的设计和氧化还原反应的相关知识,为高频考点,把握物质的性质、发生的反应及离子的检验为解答的关键,题目难度不大.

练习册系列答案
相关题目
5.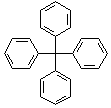 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有碳原子可能在同一平面上 | |
| C. | 该化合物分子一定处于同一平面的原子至少有12个 | |
| D. | 分子中可能处于同一平面的原子最多有23个 |
4.第三周期元素R,它的原子最外电子层达到稳定结构所所需的电子数少于次外层与最内层电子数之差,且等于最内层电子数的整数倍,关于R的叙述中正确的是( )
| A. | R的气态氢化物的水溶液具有强酸性 | |
| B. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| C. | R是金属元素 | |
| D. | R的气态氢化物不能在氧气中燃烧 |
11.设NA为阿伏伽德罗常数值.下列说法正确的是( )
| A. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA | |
| B. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| C. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| D. | 50ml浓度为18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 28 g氮气所含的原子数目为NA | |
| B. | 4 g金属钙变成离子时失去的电子数目为0.1NA | |
| C. | 22.4 L CH4的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4 L CH4和氧气的混合物所含的分子数为NA |