题目内容
计算:在50ml 1mol/L的AlCl3溶液中加入3mol/L的NaOH溶液要生成1.56g的沉淀需要加入NaOH多少ml.
考点:化学方程式的有关计算
专题:计算题
分析:50mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.05L×1mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.05mol×78g/mol=3.9g>1.56g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答:
解:50mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.05L×1mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.05mol×78g/mol=3.9g>1.56g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n[Al(OH)3]=
=0.02mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,加入NaOH溶液的体积为
=0.02L=20mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3+OH-═AlO2-+2H2O
(0.05-0.02)mol (0.05-0.02)mol
则消耗的碱的物质的量为0.15mol+(0.05-0.02)mol=0.18mol,
加入NaOH溶液的体积为
=0.06L=60mL,
答:需要需要加入NaOH溶液体积为20mL或60mL.
n[Al(OH)3]=
| 1.56g |
| 78g/mol |
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,加入NaOH溶液的体积为
| 0.06mol |
| 3mol/L |
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3+OH-═AlO2-+2H2O
(0.05-0.02)mol (0.05-0.02)mol
则消耗的碱的物质的量为0.15mol+(0.05-0.02)mol=0.18mol,
加入NaOH溶液的体积为
| 0.18mol |
| 3mol/L |
答:需要需要加入NaOH溶液体积为20mL或60mL.
点评:本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

练习册系列答案
相关题目
 下列反应中的能量变化符合如图的是 ( )
下列反应中的能量变化符合如图的是 ( )| A、酸与碱的中和反应 |
| B、石灰石分解反应 |
| C、氧化钙和水反应 |
| D、乙醇在空气中燃烧 |
可用于鉴别以下三种化合物的一组试剂是( )

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液.
| A、①与② | B、③与④ |
| C、①与④ | D、②与③ |

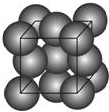 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.