题目内容
11.其他条件不变的情况下,下列说法不正确的是( )| A. | 对于反应nA(g)+B(g)?2C(g),平衡后增大压强,A的百分含量减小,则n≥2 | |
| B. | 对于反应2A(g)?B(g)△H<0,恒温恒容,压强不再变化说明反应达到平衡状态 | |
| C. | 对于反应2A(g)?B(g),恒温恒容条件下,气体密度不变,说明达到平衡状态 | |
| D. | 对于反应2A(g)?B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态 |
分析 A.于反应nA(g)+B(g)?2C(g),平衡后增大压强,A的百分含量减小,平衡正向移动,增大压强平衡向气体体积减小的方向移动;
B.对于反应2A(g)?B(g)△H<0,反应前后气体物质的量减小,当混合气体的压强不变时反应达到平衡状态;
C.对于反应2A(g)?B(g),恒温恒容条件下,无论是否达到平衡状态,气体密度始终不变;
D.同一化学反应中正逆反应速率相等,反应达到平衡状态.
解答 解:A.平衡后增大压强,A的百分含量减小,说明增大压强,平衡正向移动.根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动,正反应方向是气体体积减小的反应方向.所以n+1>2,n>1,由于为正整数.所以n≥2,故A正确;
B.由于该反应是反应前后气体体积不等的放热反应,所以根据平衡移动原理,若在恒温恒容条件下,压强不再变化,则说明反应达到平衡状态,故B正确;
C.在恒温恒容条件下,无论反应是否发生,也无论反应是否达到平衡,气体密度都不变,因此不能说明反应是否达到平衡状态,故C错误;
D.在任何时刻都存在v(A)正=2v(B)正;若v(A)正=2v(B)逆则v(B)正=v(B)逆,对于同种物质来说,正反应与逆反应速率相等,则反应达到了平衡状态,故D正确;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为化学平衡状态判断依据,当反应前后改变的物理量不变时可逆反应达到平衡状态,易错选项是D.

练习册系列答案
相关题目
18.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某有机物与溴的四氯化碳 溶液混合 | 溶液褪色 | 该有机物中必定含有 碳碳双键 |
| B | 向亚硫酸钠溶液中滴加硝酸 钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液己变质 |
| C | 向酸性高锰酸钾溶液中滴加 双氧水 | 紫色褪去,产生气泡 | H202具有还原性 |
| D | 向油脂皂化反应后的溶液中 滴入酚酞 | 溶液不变红 | 油脂己经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |
15.下列有关物质分离的说法合理的是( )
| A. | 除去KNO3中少量NaCl,将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| B. | 除去氯化钙溶液中的氯化铁杂质,加生石灰调节溶液的pH为3.7,再过滤 | |
| C. | 除去乙烷中混有的少量乙烯,将混合气体通入足量酸性KMnO4溶液中 | |
| D. | 加热法除去Ca(0H)2固体中混有的NH4Cl固体. |
16.下列说法中正确的是( )
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 | |
| B. | NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 | |
| C. | 蔗糖、乙醇在液态和水溶液里均不导电,所以它们是非电解质 | |
| D. | 烧碱、冰醋酸、石墨均为电解质 |
1.下列分子中,所有原子都处于同一平面上的是( )
| A. | 丁烯 | B. | 丙炔 | C. | 乙烷 | D. | 苯 |
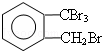
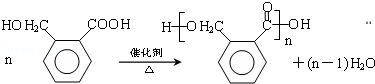
 (R、R′、R〞表示氢、烷基或芳基)合成五元环有机化合物J 的路线如下:
(R、R′、R〞表示氢、烷基或芳基)合成五元环有机化合物J 的路线如下:
 ,它的分子子中有3种不同类型的官能团,它是J的同分异构体;
,它的分子子中有3种不同类型的官能团,它是J的同分异构体; ;
; +H2O;E的核磁共振氢谱中应该具有6组峰.
+H2O;E的核磁共振氢谱中应该具有6组峰. .
. 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.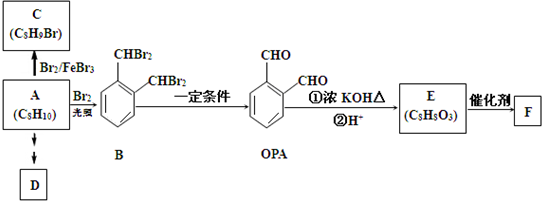

 ;
; ;
; .
.
 .
. .
.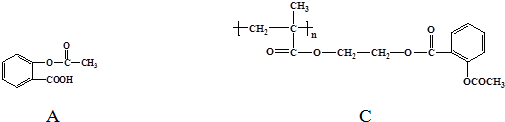
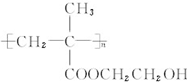 .
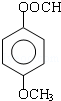
.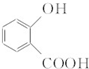 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).