题目内容
20.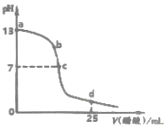 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )| A. | a~c区间内(不包含a、c两点)可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | c点时溶液中:c(Na+)=c(CH3COO-) | |
| C. | d点时溶液中:c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.2000mol•L-1 | |
| D. | 反应过程中溶液中阴、阳离子总数:b点小于c点 |
分析 A.当加入醋酸溶液较少时,溶液中可能满足c(OH-)>c(CH3COO-);
B.c点溶液呈中性,结合电荷守恒判断;
C.d点溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)<0.1000mol•L-1,结合电荷守恒判断;
D.钠离子数目不变,c点为中性,b→c阴离子数目减少.
解答 解:A.a~c区间内(不包含a、c两点),当加入的醋酸较少时,离子浓度可以满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A正确;
B.c点时溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),故B正确;
C.d点加入25mL 0.2000mol•L-1 CH3COOH溶液时,反应后溶质为0.1000mol/L的醋酸和醋酸钠;根据电荷守恒可知c(Na+)+c(H+)+c(CH3COO-)-c(OH-)=c(CH3COO-)+c(OH-)+c(CH3COO-)-c(OH-)=2c(CH3COO-),由于醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)<0.1000mol•L-1,所以c(Na+)+c(H+)+c(CH3COO-)-c(OH-)<0.2000mol•L-1,故C错误;
D.溶液中钠离子数目不变,c点为中性,b点为碱性,b→c阴离子数目减少,所以阴、阳离子总数目:b 点大于c点,故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确图象曲线各点对应溶质为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系,能够利用电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
15.某小组为研究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其他电极均为石墨盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )
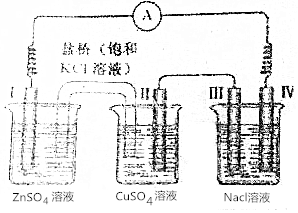

| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
12.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒的运动是有规律的,胶体中分散质微粒的运动是布朗运动 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光路 |
10.在含有Fe3+和Cu2+的溶液里,加入一定量铁粉,反应完成后过滤,滤渣全部是Cu,则关于滤液成分的说法,正确的是( )
| A. | 肯定含有Fe3+和Fe2+,肯定没有Cu2+ | |
| B. | 肯定含有Fe3+,肯定没有Cu2+,可能含Fe2+ | |
| C. | 肯定含有Cu2+,肯定没有Fe3+,可能含有Fe2+ | |
| D. | 肯定含有Fe2+,肯定没有Fe3+,可能含有 Cu2+ |
 .
.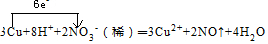 .
.
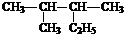 2,3-二甲基戊烷
2,3-二甲基戊烷