题目内容
9.已知甲烷的燃烧热为-890.3kJ/mol,氮气与氧气反应生成NO的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol,写出甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1960.6kJ•mol-1.分析 甲烷的燃烧热为-890.3kJ/mol,说明生成液态水和二氧化碳放出890.3kJ热量,结合盖斯定律计算CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H.
解答 解:甲烷的燃烧热为-890.3kJ/mol,说明生成液态水和二氧化碳放出890.3kJ热量,热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
则已知①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
②×2-①得:2CH4(g)+2NO(g)+3O2(g)═2CO2(g)+4H2O(l)+N2(g),△H,依据盖斯定律△H=2△H2-△H1=-890.3kJ•mol-1×2-180kJ•mol-1
=-1960.6kJ•mol-1;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol;-1960.6kJ•mol-1.
点评 本题考查了用盖斯定律进行有关反应热的计算,为高频考点,侧重考查学生的分析能力和计算能力,难度不大,首先写出热化学方程式的方程式部分,然后以该方程式为目标对已知热化学方程式进行变形.

练习册系列答案
相关题目
19.用NA表示阿伏加徳罗常数的数值,下列判断正确的是( )
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
20.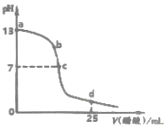 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )| A. | a~c区间内(不包含a、c两点)可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | c点时溶液中:c(Na+)=c(CH3COO-) | |
| C. | d点时溶液中:c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.2000mol•L-1 | |
| D. | 反应过程中溶液中阴、阳离子总数:b点小于c点 |
17.下列说法或表示方法正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 相同条件下,1mol H2O(l)完全分解吸收的热量与H2、O2化合生成1mol H2O(l)放出的热量值不相等 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=+285.8kJ/mol |
1.下列关于有机物的说法正确的是( )
| A. | 有机物只能存在于动植物体内,不能通过人工的方法合成 | |
| B. | 有机物只含有碳、氢两种元素 | |
| C. | 含碳元素的化合物不一定属于有机物 | |
| D. | 烃是指燃烧后只生成CO2和H2O的有机物 |
18. 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗NaOH溶液的体积肯定小于20.00mL | |
| D. | pH>7时,消耗NaOH溶液的体积肯定大于20.00mL |