题目内容
10.标准状况下,向两个密闭容器中分别充满等质量的O2、O3气体,(1)两气体的物质的量之比为3:2,
(2)两种容器的原子个数之比为1:1,
(3)两种气体的密度之比是2:3.
分析 (1)等质量的O2、O3气体,说明氧原子的物质的量相等,而氧气是双原子分子,O3是三原子分子;
(2)等质量的O2、O3气体,说明氧原子的物质的量相等;
(3)两种气体的物质的量之比为3:2,则体积之比为3:2,根据ρ=$\frac{m}{V}$分析解答.
解答 解:(1)等质量的O2、O3气体,说明氧原子的物质的量相等,而氧气是双原子分子,O3是三原子分子,所以两气体的物质的量之比为3:2,故答案为:3:2;
(2)等质量的O2、O3气体,说明氧原子的物质的量相等,所以两种容器的原子个数之比为1:1,故答案为:1:1;
(3)两种气体的物质的量之比为3:2,则体积之比为3:2,由ρ=$\frac{m}{V}$可知,密度之比与体积成反比,所以两种气体的密度之比是2:3,故答案为:2:3.
点评 本题考查阿伏加德罗定律及其推论,题目难度不大,本题注意把握两种气体的元素组成特点,结合PV=nRT判断.

练习册系列答案
相关题目
18.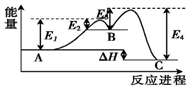 某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A→B为吸热反应,B→C为放热反应 | B. | 三种化合物中B最稳定 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 整个反应的△H=E1-E2 |
5.小强总是把阿伏加德罗常数写成Na,于是老师罚他把阿伏加德罗常数写NA遍.设NA为阿伏加德罗常数的值,聪明的你认为下列说法正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA | |
| D. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA |
2.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L NO与11.2L O2混合充分反应,产物的分子数为NA | |
| B. | 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA | |
| C. | l mol Cu与足量的硫充分反应,电子转移数为2NA | |
| D. | 100mL l mol•L-1KClO溶液中,阴离子的数目小于0.1NA |
19.用NA表示阿伏加徳罗常数的数值,下列判断正确的是( )
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
20.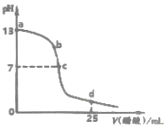 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )| A. | a~c区间内(不包含a、c两点)可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | c点时溶液中:c(Na+)=c(CH3COO-) | |
| C. | d点时溶液中:c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.2000mol•L-1 | |
| D. | 反应过程中溶液中阴、阳离子总数:b点小于c点 |
 ,取代反应.
,取代反应.
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl;
+HCl; .
. 的同分异构体有多种,其中满足下列条件的同分异构体有6种,其中苯环上的一氯代物有两种的同分异构体的结构简式为
的同分异构体有多种,其中满足下列条件的同分异构体有6种,其中苯环上的一氯代物有两种的同分异构体的结构简式为 、
、 .
.