题目内容
(1)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2 670.9kJ的热量,写出该反应的热化学方程式
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:
(3)HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为 .
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:
(3)HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)依据热化学方程式书写方法书写,标注物质聚集状态,计算对应化学方程式量下的焓变写出热化学方程式;
(2)n(NH3)=
=
mol,则分解1molNH3吸收17×2.7kJ=45.9kJ能量;
(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(2)n(NH3)=
| 1g |
| 17g/mol |
| 1 |
| 17 |
(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
解答:
解:(1)3mol甲烷完全燃烧生成液态水时放出2670.9KJ热量,1mol甲烷反应燃烧反应放热
KJ=890.3KJ;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(2)n(NH3)=
=
mol,则分解1molNH3吸收17×2.7kJ=45.9kJ能量,分解2molNH3放热91.8KJ,反应的热化学方程式为:2NH3(g)═N2(g)+3H2(g)△H=-92.8kJ/mol;
故答案为:2NH3(g)═N2(g)+3H2(g)△H=-92.8kJ/mol;
(3)HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
| 2670.9 |
| 3 |
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(2)n(NH3)=
| 1g |
| 17g/mol |
| 1 |
| 17 |
故答案为:2NH3(g)═N2(g)+3H2(g)△H=-92.8kJ/mol;
(3)HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查中和热以及热化学方程式的书写问题,本题难度不大,注意准确理解中和热的概念.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在配制物质的量浓度时,以下情况会使所配溶液浓度偏高的是( )
| A、定容时仰视刻度线 |
| B、未等溶液冷却至室温就进行定容 |
| C、转移溶液后,未洗涤烧杯和玻璃棒 |
| D、溶液在引流时溅出容器外 |
对下列有机反应类型的判断中不正确的是( )
A、CH3CH2OH+CH3COOH
| |||
B、CH2=CH2+HOCl
| |||
C、2CH3CH2OH+O2
| |||
D、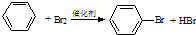 加成反应 加成反应 |
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式: