题目内容
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是
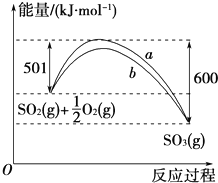
(2)如图是SO2生成SO3反应过程中能量变化的曲线图.该反应的热化学方程式为:
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)图象分析可知是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,据此写出反应的热化学方程式;
(2)图象分析可知是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,据此写出反应的热化学方程式;
解答:
解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,2mol二氧化硫全部反应放热198 kJ;写出反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1 ,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1 ;
故答案为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,2mol二氧化硫全部反应放热198 kJ;写出反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1 ,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ?mol-1 ;
点评:本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目难度中等,注重基础知识的考查.

练习册系列答案
相关题目
室温下有下列四种溶液:①0.1mol?L-1氨水 ②0.1mol?L-1NH4Cl溶液 ③含有0.1mol?L-1盐酸和0.1mol?L-1 NH4Cl的混合溶液 ④含有0.1mol?L-1 NaOH溶液和0.1mol?L-1氨水的混合溶液,四种溶液中c(NH4+)由小到大排列正确的是( )
| A、②③④① | B、④①②③ |
| C、①④②③ | D、③②①④ |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L氧气做氧化剂时转移的电子数一定是4NA |
| B、1mol硝基(-NO2)与NA个二氧化氮(NO2)分子所含的电子数相等 |
| C、80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.24NA |
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
 (9)CH2=CH-CH3(8)
(9)CH2=CH-CH3(8) (10)
(10) (11)2,2-二甲基丁烷
(11)2,2-二甲基丁烷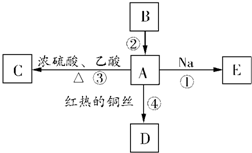 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
 ),其反应类型是
),其反应类型是