题目内容
写出下列方程式:
(1)CH3COOH(电离)
(2)H2O(电离)
(3)NH4Cl(水解)
(4)Na2CO3(水解) .
(1)CH3COOH(电离)
(2)H2O(电离)
(3)NH4Cl(水解)
(4)Na2CO3(水解)
考点:电离方程式的书写,盐类水解的原理
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:强电解质在溶液中能完全电离,弱电解质则部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不要拆开.
解答:
解:(1)醋酸是弱酸,只能部分电离,电离方程式为:CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(2)水是弱电解质,只能部分电离,电离方程式为:H2O?H++OH-,故答案为:H2O?H++OH-;
(3)氯化铵中的铵根离子会水解,显酸性,即NH4Cl+H2O?NH3?H2O+HCl,故答案为:NH4Cl+H2O?NH3?H2O+HCl;
(4)N碳酸钠中的碳酸根离子会水解,溶液显示碱性,即Na2CO3+H2O?NaHCO3+NaOH,故答案为:Na2CO3+H2O?NaHCO3+NaOH.
(2)水是弱电解质,只能部分电离,电离方程式为:H2O?H++OH-,故答案为:H2O?H++OH-;
(3)氯化铵中的铵根离子会水解,显酸性,即NH4Cl+H2O?NH3?H2O+HCl,故答案为:NH4Cl+H2O?NH3?H2O+HCl;
(4)N碳酸钠中的碳酸根离子会水解,溶液显示碱性,即Na2CO3+H2O?NaHCO3+NaOH,故答案为:Na2CO3+H2O?NaHCO3+NaOH.
点评:本题考查了电离方程式和水解方程式的书写知识,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
相关题目
室温下有下列四种溶液:①0.1mol?L-1氨水 ②0.1mol?L-1NH4Cl溶液 ③含有0.1mol?L-1盐酸和0.1mol?L-1 NH4Cl的混合溶液 ④含有0.1mol?L-1 NaOH溶液和0.1mol?L-1氨水的混合溶液,四种溶液中c(NH4+)由小到大排列正确的是( )
| A、②③④① | B、④①②③ |
| C、①④②③ | D、③②①④ |
以下元素的原子半径递变规律正确的是( )
| A、Be<B<Na<Mg |
| B、B<Be<Mg<Na |
| C、Be<B<Mg<Na |
| D、B<Be<Na<Mg |
250mL物质的量浓度为2mol?L-1的硫酸溶液,下列说法正确的是( )
| A、取50ml该溶液,含硫酸的物质的量为10mol?L-1 |
| B、含硫酸的物质的量为0.5mol |
| C、含硫酸的物质的量为2mol?L-1 |
| D、含硫酸的物质的量为1mol |
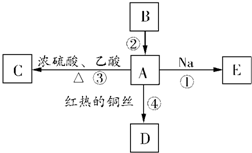 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
 ),其反应类型是
),其反应类型是