题目内容
18.在同温同压下用排气法收集NH3和HCl进行喷泉实验(如图),下列说法错误的是(设Vm表示该条件下气体摩尔体积)( )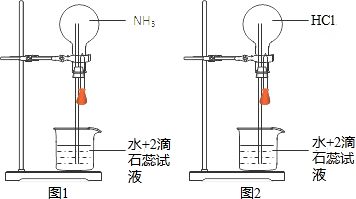
| A. | 所得溶液中溶质的物质的量浓度均为$\frac{1}{{V}_{m}}$mol•L-1 | |
| B. | “喷泉”结束时烧瓶内充满液体 | |
| C. | 图2可通过膨胀法引发“喷泉” | |
| D. | 图1、图2中喷泉的颜色分别为蓝色、红色 |
分析 A、设圆底烧瓶中氨气和HCl的体积均为VL,则喷泉实验后溶液体积为VL;
B、气体是用排空气法收集的,故气体中均有空气;
C、用手捂住图2的烧瓶,则气体会逸出;
D、氨气溶于水后显碱性;HCl溶于水后显酸性.
解答 解:A、设圆底烧瓶中氨气和HCl的体积均为VL,则氨气或HCl的物质的量为n=$\frac{V}{Vm}mol$,喷泉实验后溶液体积为VL,故所得溶液的浓度为c=$\frac{\frac{V}{Vm}mol}{VL}$=$\frac{1}{Vm}$mol/L,故A正确;
B、气体是用排空气法收集的,故气体中均有空气,故实验结束时烧瓶内液体不能充满,故B错误;
C、用手捂住图2的烧瓶,则气体会逸出,从而引起烧瓶内的压强减小,则引起喷泉,故C正确;
D、氨气溶于水后显碱性,遇石蕊变蓝;HCl溶于水后显酸性,遇石蕊变红,故D正确.
故选B.
点评 本题考查了氨气和HCl的喷泉实验,注意所得溶液浓度的计算方法,由于氨气和HCl均由排空气法收集,故喷泉实验后溶液不能充满整个烧瓶.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
| A. | a-4 | B. | a+8 | C. | a-5 | D. | a+4 |
9.下列互为同位素的是( )
| A. | H2 D2 | B. | 14N 14C | C. | 16O 17O | D. | 金刚石 石墨 |
6.(1)①常温下将0.15mol/L的稀硫酸V1 mL与0.1mol/L的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=1:1(总体积按V1+V2计).
②常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是AD.
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2↑
(3)铅及其化合物可用于蓄电池及X射线防护材料等.回答下列问题:
PbO2可通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生的电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+,阴极上观察到的现象是石墨上包上铜镀层;加入Cu(NO3)2的作用为:提高Pb2+的利用率.
②常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是AD.
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2↑
(3)铅及其化合物可用于蓄电池及X射线防护材料等.回答下列问题:
PbO2可通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生的电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+,阴极上观察到的现象是石墨上包上铜镀层;加入Cu(NO3)2的作用为:提高Pb2+的利用率.
13.实验室常用CS2溶解硫磺(S8)或白磷(P4),下列推测错误的是( )
| A. | CS2是非极性分子 | B. | CS2的沸点高于CO2 | ||
| C. | CS2不能在空气中燃烧 | D. | CS2能证明非金属性S>C |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 24g镁的原子最外层电子数为NA | |
| B. | 0.3mol O2与一定量的Fe3+在一定条件下完全反应,生成Fe2O3和Fe3O4的混合物,则转移电子数为1.2mol | |
| C. | 2L 0.1mol/L氯化铁溶液中含有Fe的数目为0.2NA | |
| D. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
10.某长期放置的FeSO4溶液,略显棕黄色,为了证明其是否变质以及是否完全变质,依次选用的试剂合理的是( )
| A. | KSCN溶液:酸性KMnO4溶液 | B. | NaOH溶液:Fe粉 | ||
| C. | KSCN溶液:NaOH溶液 | D. | 氨水:NaOH溶液 |
13.下列反应的现象描述与离子方程式都正确的是( )
| 选项 | 反应过程 | 反应现象 | 离子方程式 |
| A | 金属镁与稀盐酸反应 | 有气泡逸出 | Mg+2H++2C-═MgCl2+H2↑ |
| B | 氣化钡溶液与稀硫酸反应 | 有白色沉淀生成 | Ba2++SO42-═BaS04↓ |
| C | 碳酸钠与盐酸反应 | 有气泡逸出 | Na2C03+2H+═CO2↑+H20+ 2Na+ |
| D | 硫酸铜溶液中加入过量的NaOH溶液 | 有白色沉淀产生 | Cu2++20H-═Cu(0H)2↓ |
| A. | A | B. | B | C. | C | D. | D |