题目内容
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 24g镁的原子最外层电子数为NA | |
| B. | 0.3mol O2与一定量的Fe3+在一定条件下完全反应,生成Fe2O3和Fe3O4的混合物,则转移电子数为1.2mol | |
| C. | 2L 0.1mol/L氯化铁溶液中含有Fe的数目为0.2NA | |
| D. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
分析 A.镁原子最外层含有2个电子,24g镁的物质的量为1mol,含有2mol最外层电子;
B.反应产物中氧元素的化合价为-2价,根据电子守恒计算出转移电子数;
C.铁离子部分水解,导致铁离子数目减少;
D.所得溶液体积不是1L,所得溶液浓度不是1mol/L.
解答 解:A.24gMg的物质的量为:$\frac{24g}{24g/mol}$=1mol,1molMg含有2mol最外层电子,含有的最外层电子数为2NA,故A错误;
B.Fe2O3和Fe3O4中氧元素的化合价为-2价,根据电子守恒可知0.3mol氧气完全反应转移了1.2mol电子,故B正确;
C.2L 0.1mol/L氯化铁溶液中含有溶质氯化铁的物质的量为0.2mol,由于铁离子部分水解,导致溶液中含有的铁离子小于0.2mol,含有Fe3+的数目小于0.2NA,故C错误;
D.58.5g氯化钠的物质的量为1mol,1mol氯化钠溶于1L水中,所得溶液体积不是1L,则如的浓度不是1mol/L,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,D为易错点,注意体积体积不是1L.

练习册系列答案
相关题目
13.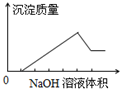 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )| A. | Mg2+、Al3+、Fe3+ | B. | H+、Mg2+、Al3+ | C. | H+、Ba2+、Al3+ | D. | Na+、Mg2+、Al3+ |
11.向200mL稀硝酸溶液中加人11.2g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加7.0g,则所得溶液中Fe3+的物质的量浓度约为( )
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1 |
18.在同温同压下用排气法收集NH3和HCl进行喷泉实验(如图),下列说法错误的是(设Vm表示该条件下气体摩尔体积)( )
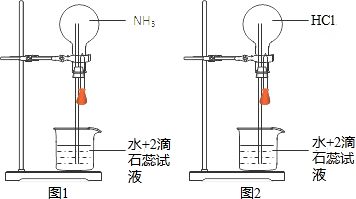

| A. | 所得溶液中溶质的物质的量浓度均为$\frac{1}{{V}_{m}}$mol•L-1 | |
| B. | “喷泉”结束时烧瓶内充满液体 | |
| C. | 图2可通过膨胀法引发“喷泉” | |
| D. | 图1、图2中喷泉的颜色分别为蓝色、红色 |
1.下列选项正确的是( )
| A. | 0.1 mol•L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量浓度的三种溶液:①(NH4)2SO4、②NH4Cl、③NH3•H2O中,c(NH4+)的大小顺序为:③>②>① | |
| C. | 25℃时,pH=4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O22-) | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
18.下列分子中,所有原子都处在同一平面的是( )
| A. | 环已烯 | B. | 苯 | C. | 丙烷 | D. | 丙炔 |
19.下列实验事实不能用勒夏特列原理解释的是( )
| A. |
| |||||||||
| B. |
| |||||||||
| C. | 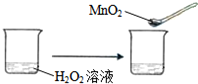 | |||||||||
| D. | 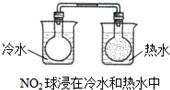 |
 一定质量的镁、铝混合物投到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
一定质量的镁、铝混合物投到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: