题目内容
11.如图所示,是一个制取氯气并验证氯气性质得装置,其中各试剂瓶装的试剂为:B(淀粉-KI溶液)、C(氯化亚铁溶液)、D、(混有二氧化硫的氯化钡溶液)、E(亚硫酸钠溶液)、F(紫色石蕊试液).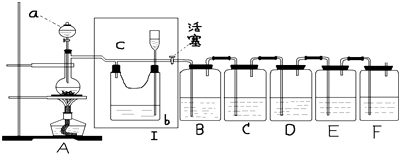
(1)制备氯气选用的药品为二氧化锰和浓盐酸,A是氯气发生装置,其中仪器a的名称为分液漏斗,化学反应方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置I的作用是吸收氯气中等氯化氢,安全瓶检验装置是否发生堵塞.
(3)下列装置中的现象是B溶液变蓝色;D产生白色沉淀;F溶液先变红后褪色.
(4)写出在C装置中发生反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(5)请设计一个实验,证明洗气瓶E中的亚硫酸钠已被氧化取待测液放置与试管中,先加入足量的盐酸,然后再加入氯化钡溶液,若产生白色沉淀,可证明亚硫酸钠被氧化;.
分析 (1)熟悉仪器形状说出其名称;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯气、氯化氢的性质选择合适的除杂剂;
同时装置Ⅰ可以作为安全瓶检验装置是否发生堵塞,装置堵塞时,Ⅰ中长颈漏斗内液面上升;
(3)氯气与强的氧化性,能够与碘化钾反应生成单质碘;能够氧化氯化亚铁生成氯化铁;能够氧化二氧化硫生成亚硫酸,亚硫酸与氯化钡溶液反应生成亚硫酸钡沉淀;能够与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;
(4)氯气与氯化亚铁反应生成氯化铁;
(5)Na2SO3被氧化为硫酸钠,利用硫酸钠与氯化钡反应生成硫酸钡沉淀检验硫酸根离子的存在,注意检验前应排除亚硫酸根离子的干扰.
解答 解:(1)仪器a为分液漏斗;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:分液漏斗;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,可以溶液饱和食盐水吸收氯气中等氯化氢;同时装置Ⅰ可以作为安全瓶检验装置是否发生堵塞,装置堵塞时,Ⅰ中长颈漏斗内液面上升;
故答案为:吸收氯气中等氯化氢;安全瓶检验装置是否发生堵塞;
(3)氯气与强的氧化性,能够与碘化钾反应生成单质碘,碘遇到淀粉变蓝,所以溶液变蓝色;能够氧化氯化亚铁生成氯化铁,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;能够氧化二氧化硫生成亚硫酸,亚硫酸与氯化钡溶液反应生成亚硫酸钡沉淀,所以会看到产生白色沉淀;能够与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,能够使紫色石蕊试液先变红后褪色;
故答案为:溶液变蓝色;产生白色沉淀;溶液先变红后褪色;
(4)氯气与氯化亚铁反应生成氯化铁,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)亚硫酸钠被氧化生成硫酸钠,要证明亚硫酸钠氧化生成硫酸钠可以取待测液放置与试管中,先加入足量的盐酸,然后再加入氯化钡溶液,若产生白色沉淀,可证明亚硫酸钠被氧化;
故答案为:取待测液放置与试管中,先加入足量的盐酸,然后再加入氯化钡溶液,若产生白色沉淀,可证明亚硫酸钠被氧化.
点评 本题考查了氯气的制备及性质,熟悉氯气制备原理及性质是解题关键,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案①Si可用于制造光导纤维②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③铁红常用作红色油漆和涂料④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用于生产防火材料 ⑥氯气具有漂白性,可以使有色布条褪色.
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
| A. | 乙烯能使酸性高锰酸钾溶液褪色,甲烷则不能使其褪色 | |
| B. | 溶于水能导电的化合物不一定是离子化合物 | |
| C. | 需要加热的反应不一定是吸热反应 | |
| D. | 石油的分馏和煤的干馏都是化学变化 |
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
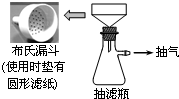 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.