题目内容
2.某无色透明溶液与铝反应放出氢气,该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、CO32-离子中的某些离子,试推断:(1)若溶液呈强酸性,则一定大量含有的阴离子为H+、Cl-;
(2)若溶液呈强碱性,则一定大量含有的阳离子为K+、0H-.
分析 无色透明溶液与铝反应放出氢气,为非氧化性酸或强碱溶液,
(1)酸性溶液中,与氢离子反应的离子不能大量存在;
(2)碱性溶液中与氢氧根离子反应的离子不能大量存在,以此来解答.
解答 解:无色透明溶液与铝反应放出氢气,为非氧化性酸或强碱溶液,且溶液为电中性,
(1)酸性溶液中,与氢离子反应的0H-、CO32-离子不能大量存在,根据溶液电中性,则一定存在H+、Cl-,可能存在K+、Mg2+,
故答案为:H+、Cl-;
(2)碱性溶液中,与氢氧根离子反应的H+、Mg2+离子不能大量存在,结合溶液电中性可知一定存在K+、0H-,可能存在Cl-、CO32-,
故答案为:H+、Cl-;K+、0H-.
点评 本题考查离子共存的判断、常见离子的检验方法,为高考高频考点,题目难度中等,明确离子反应发生条件为解答的关键,注意掌握常见离子的性质及检验方法.

练习册系列答案
相关题目
13.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2=2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
4.关于如图所示的原电池,下列说法正确的是( )


| A. | 锌电极发生还原反应:铜电极发生氧化反应 | |
| B. | 铜电极做正极发生的电极反应为:2H++2e-═H2↑ | |
| C. | 当有13g Zn溶解时,电路中就有0.5mol电子通过 | |
| D. | 电子从锌电极通过电流表流向铜电极 |
 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则: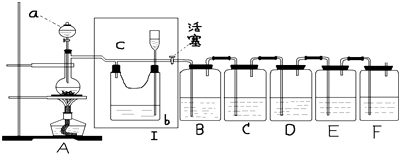
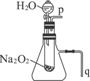 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.