题目内容
将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为( )
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
考点:氧化还原反应的计算
专题:
分析:已知Br2能氧化SO2,向含有HBr和SO2的溶液里通入氯气,氯气先和二氧化硫反应生成硫酸,然后氯气再和溴离子反应生成溴单质,根据氧化还原反应中得失电子守恒计算原溶液中HBr和SO2的物质的量.
解答:
解:设二氧化硫和溴化氢的物质的量都为x.
氯气和溴化氢、二氧化硫反应的方程式分别为:Cl2+2HBr=Br2+2HCl、Cl2+SO2+2H2O=H2SO4+2HCl,
由方程式知,反应中氯元素得电子的物质的量为1mol×2=2mol,
硫元素失电子的物质的量为x×(6-4)=2x,
溴元素失电子的物质的量为x×1×
=0.5x,
根据氧化还原反应中得失电子数相等得2mol=2x+0.5x,
x=0.8mol,
原混合气体中SO2的物质的量都为0.8mol,
故选A.
氯气和溴化氢、二氧化硫反应的方程式分别为:Cl2+2HBr=Br2+2HCl、Cl2+SO2+2H2O=H2SO4+2HCl,
由方程式知,反应中氯元素得电子的物质的量为1mol×2=2mol,
硫元素失电子的物质的量为x×(6-4)=2x,
溴元素失电子的物质的量为x×1×
| 1 |
| 2 |
根据氧化还原反应中得失电子数相等得2mol=2x+0.5x,
x=0.8mol,
原混合气体中SO2的物质的量都为0.8mol,
故选A.
点评:本题考查了氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,根据氧化还原反应中得失电子守恒进行分析解答即可.

练习册系列答案
相关题目
将45mL0.1mol/LHCl溶液和5mL0.5mol/L Ba(OH)2溶液相混合并再释至500mL,所得溶液的pH等于( )
| A、2.4 | B、3 | C、11 | D、12 |
下列有关化学用语的说法中正确的是( )
| A、次氯酸的结构式为:H-Cl-O |
B、-OH与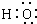 都表示羟基 都表示羟基 |
C、S2-的结构示意图:S2-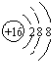 |
D、苯分子的球棍模型示意图: |
用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A、标准状总下11.2L臭氧中含有1.5NA个氧原子 |
| B、NO2与N2O4混合气体46g含有的原了总数为3NA |
| C、1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| D、100mL 0.2mol?L-1稀硫酸中含有硫酸根的个数为0.2NA |
下列物质中,一氯代物种数最多的是( )
| A、邻二乙苯 |
| B、2-甲基-3-乙基戊烷 |
| C、乙苯 |
| D、1-甲基-3-乙基环己烷 |
 向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:
向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:
 .请回答下列问题:
.请回答下列问题: