题目内容
 向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:
向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:(1)a、b、c、d中c(H+)最大的是
(2)如果要使c点的c(H+)等于d点,除了加水以外,还可以采取的方法有:
①
(3)常温下,d点水电离出c(H+)等于10-x,则溶液的pH=
(4)常温下,c点的pH=y,体积为1L,某等体积的氢氧化钠溶液的pH=14-y,若两者混合,溶液pH
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据浓度越大,导电能力越强,浓度越大电离程度越小来分析;
(2)如果要使c点的c(H+)等于d点,即减小氢离子浓度,可以从使电离平衡向逆反应方向移动或者消耗氢离子来分析;
(3)根据pH=-lgc(H+),醋酸的电离常数K=
进行计算.
(4)因为醋酸为弱酸,部分电离,c点的pH=y,体积为1L,某等体积的氢氧化钠溶液的pH=14-y,若两者混合醋酸远远过量,所以溶液pH>7;若两溶液稀释同等倍数,醋酸是弱电解质,PH变化比氢氧化钠小,据此分析;
(2)如果要使c点的c(H+)等于d点,即减小氢离子浓度,可以从使电离平衡向逆反应方向移动或者消耗氢离子来分析;
(3)根据pH=-lgc(H+),醋酸的电离常数K=
| c(CH3COO -)c(H +) |
| c(CH3COOH) |
(4)因为醋酸为弱酸,部分电离,c点的pH=y,体积为1L,某等体积的氢氧化钠溶液的pH=14-y,若两者混合醋酸远远过量,所以溶液pH>7;若两溶液稀释同等倍数,醋酸是弱电解质,PH变化比氢氧化钠小,据此分析;
解答:
解:(1)浓度越大,导电能力越强,由图象知a、b、c、d中b点导电能力最强,所以c(H+)最大的是b;浓度越大电离程度越小,由图象知a、b、c、d中d点浓度最小,则n(H+)最大;故答案为:b;d;
(2)要使c点的c(H+)等于d点,即减小氢离子浓度,可以采用降低温度或者加入醋酸钠固体使电离平衡向逆反应方向移动;还可以加入氢氧化钠固体消耗氢离子使氢离子浓度降低,故答案为:①降低温度;②加入醋酸钠固体;③加入氢氧化钠固体;
(3)常温下,d点水电离出c(H+)等于10-x,即溶液中的氢氧根为10-x,所以d点溶液中的氢离子浓度=
,则溶液的pH=14-x;若此时醋酸分子的浓度为0.1mol/L,则醋酸的电离常数K=
=
=10(2x-27),故答案为:14-x;10(2x-27);
(4)因为醋酸为弱酸,部分电离,c点的pH=y,体积为1L,与等体积的氢氧化钠溶液的pH=14-y混合,醋酸远远过量,所以溶液pH>7;若两溶液稀释同等倍数,醋酸是弱电解质,稀释的过程中还要电离出氢离子,故PH变化比氢氧化钠小,所以若两溶液稀释同等倍数,醋酸的pH=z,则氢氧化钠溶液的PH存在:(14-y)-PH>(z-y),解得pH<14-z;故答案为:<;<;
(2)要使c点的c(H+)等于d点,即减小氢离子浓度,可以采用降低温度或者加入醋酸钠固体使电离平衡向逆反应方向移动;还可以加入氢氧化钠固体消耗氢离子使氢离子浓度降低,故答案为:①降低温度;②加入醋酸钠固体;③加入氢氧化钠固体;
(3)常温下,d点水电离出c(H+)等于10-x,即溶液中的氢氧根为10-x,所以d点溶液中的氢离子浓度=
| 10 -14 |
| 10 -x |
| c(CH3COO -)c(H +) |
| c(CH3COOH) |
| 10 (x-14)×10 (x-14) |
| 0.1 |
(4)因为醋酸为弱酸,部分电离,c点的pH=y,体积为1L,与等体积的氢氧化钠溶液的pH=14-y混合,醋酸远远过量,所以溶液pH>7;若两溶液稀释同等倍数,醋酸是弱电解质,稀释的过程中还要电离出氢离子,故PH变化比氢氧化钠小,所以若两溶液稀释同等倍数,醋酸的pH=z,则氢氧化钠溶液的PH存在:(14-y)-PH>(z-y),解得pH<14-z;故答案为:<;<;
点评:本题考查弱电解质电离、电离平衡的移动以及混合、稀释等知识点,明确弱电解质电离程度与浓度关系、溶液导电能力大小影响因素等即可解答;

练习册系列答案
相关题目
2SO2(g)+O2(g)?2SO3(g)△H<0是制备硫酸的重要反应.下列叙述正确的是( )
| A、选用有效的催化剂能增大正反应速率并提高SO2的转化率 | ||
| B、增大反应体系的压强,反应速率不一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为( )
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
把一定量的有机物溶于NaOH溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的( )
A、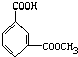 |
B、 |
C、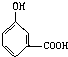 |
D、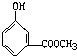 |
在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
| A、XY3一定是离子化合物 |
| B、若Y的原子序数为m,X的原子序数可能是m±4 |
| C、X和Y一定属于同一周期 |
| D、X和Y一定不属于同一主族 |
下列说法正确的是( )
| A、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| B、工艺师利用盐酸蚀刻石英制作艺术品 |
| C、除去CO2中少量的SO2,使混合气体通过盛饱和碳酸钠溶液的洗气瓶 |
| D、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料 |

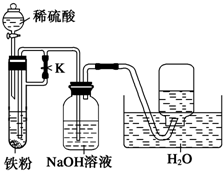 常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验: