题目内容
用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A、标准状总下11.2L臭氧中含有1.5NA个氧原子 |
| B、NO2与N2O4混合气体46g含有的原了总数为3NA |
| C、1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| D、100mL 0.2mol?L-1稀硫酸中含有硫酸根的个数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、一个臭氧分子中含有3个氧原子;
B、NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数;
C、镁为2价金属,无论生成氧化镁还是氮化镁,1mol镁完全反应失去2mol电子;
D、根据n=CV来计算;
B、NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数;
C、镁为2价金属,无论生成氧化镁还是氮化镁,1mol镁完全反应失去2mol电子;
D、根据n=CV来计算;
解答:
解:A、标况下下,11.2L臭氧的物质的量是0.5mol,一个臭氧分子中含有3个氧原子,则标准状况下,11.2L臭氧中含有1.5NA个氧原子,故A错误;
B、NO2和N2O4的最简式相同为NO2,46g NO2中所含原子数=
×3×NA=3NA,故B正确;
C、1mol镁完全反应,无论生成氮化镁还是氧化镁,化合物中镁的化合价都是+2价,则失去的电子为2mol,均失去2NA个电子,故C正确;
D、0.2mol/L100mL稀硫酸中含有硫酸根的物质的量n=CV=0.2mol/L×0.1L=0.02mol,故个数为0.02NA,故D错误;
故选D.
B、NO2和N2O4的最简式相同为NO2,46g NO2中所含原子数=
| 46g |
| 46g/mol |
C、1mol镁完全反应,无论生成氮化镁还是氧化镁,化合物中镁的化合价都是+2价,则失去的电子为2mol,均失去2NA个电子,故C正确;
D、0.2mol/L100mL稀硫酸中含有硫酸根的物质的量n=CV=0.2mol/L×0.1L=0.02mol,故个数为0.02NA,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、绿色食品是指不含任何化学物质的食品 |
| C、生物固氮是指植物将空气中的氮气转变为氮的化合物 |
| D、光导纤维是以玻璃为主要原料制成的 |
在做焰色反应的实验中,通过蓝色的钴玻璃发现火焰呈现紫色,该物质可能是( )
| A、NaCl |
| B、BaCl2 |
| C、CuCl2 |
| D、KCl |
将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为( )
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
把一定量的有机物溶于NaOH溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的( )
A、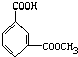 |
B、 |
C、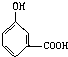 |
D、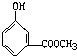 |
在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
| A、XY3一定是离子化合物 |
| B、若Y的原子序数为m,X的原子序数可能是m±4 |
| C、X和Y一定属于同一周期 |
| D、X和Y一定不属于同一主族 |
既可以通过单质与单质化合,也可以通过溶液中的复分解反应来制得的化合物是( )
| A、FeCl2 |
| B、FeCl3 |
| C、Fe2O3 |
| D、Al2S3 |
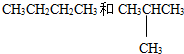 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和