题目内容
1. 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
分析 该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金上铜的物质的量,从而计算铜和锌的原子个数之比.
解答 解:B极上析出的是铜,B极质量增加7.68g,其物质的量=$\frac{7.68g}{64g/mol}$=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.04g,即锌和铜的质量差为0.04g.
设锌的物质的量为x.
Zn+Cu2+=Zn2++Cu 质量增加
1mol 1g
x 0.04g
x=0.04mol.
即合金中锌的物质的量是0.04mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设铜的物质的量为y.
0.04mol×2+2y=0.12mol×2
y=0.08mol,
所以铜和锌的物质的量之比为0.08mol:0.04mol=2:1,所以铜和锌的原子个数之比是2:1,
故选B.
点评 本题以原电池原理为载体考查了物质的量的有关计算,明确溶液中质量增加的量是什么是解本题的关键,然后根据得失电子数相等计算铜的物质的量,从而确定铜和锌的个数之比,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11. 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )
 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )| A. | 240mL | B. | 300mL | C. | 400mL | D. | 440mL |
10.下列装置所示的实验能达到实验目的是( )
| A. | 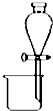 分离碘酒中的碘和酒精 | B. | 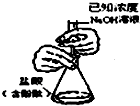 滴定法测定盐酸的浓度 | ||
| C. | 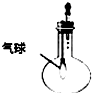 验证NH3的溶解性 | D. | 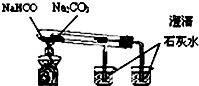 比较Na2CO2、NaHCO2的热稳定性 |
11.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 常温常压下,15gCH3+所含的电子数为9NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 某密闭容器中盛有0.2mol SO2和0.1mol O2,充分反应,生成SO3分子数为0.2NA |


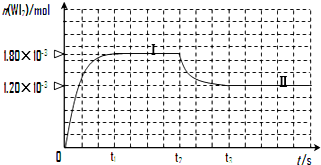 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)