题目内容
10.下列装置所示的实验能达到实验目的是( )| A. | 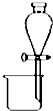 分离碘酒中的碘和酒精 | B. | 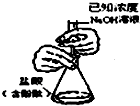 滴定法测定盐酸的浓度 | ||
| C. | 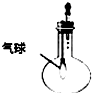 验证NH3的溶解性 | D. | 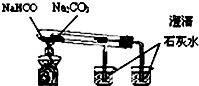 比较Na2CO2、NaHCO2的热稳定性 |
分析 A.碘和酒精不分层;
B.NaOH应利用碱式滴定管;
C.根据氨气极易溶于水对压强的影响分析;
D.碳酸氢钠应置于内置小试管中.
解答 解:A.碘和酒精不分层,不能选分液装置,故A错误;
B.NaOH应利用碱式滴定管,图中为酸式滴定管,故B错误;
C.氨气极易溶于水,烧瓶内压强减小,气球体积膨胀,可验证氨水的水溶性,故C正确;
D.碳酸氢钠易分解,为验证其稳定性,应置于内置小试管中,故D错误.
故选C.
点评 本题考查化学实验方案评价,涉及中和滴定、物质稳定性判断、物质分离和提纯、物质溶解性判断等知识点,为高频考点,侧重实验操作及实验原理考查,注意实验的评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
1. 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
5.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O 含有的分子数为 1 NA | |
| B. | 常温常压下,1.06 g Na2CO3 含有的 Na+离子数为 0.02 NA | |
| C. | 通常状况下,1 NA 个 CO2分子占有的体积为 22.4 L | |
| D. | 物质的量浓度为 0.5 mol/L 的 MgCl2溶液中,含有 Cl-个数为 1 NA |
15.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
2.下列各组物质中,肯定属于同系物的是( )
| A. | CH4O和C2H6O | B. | C3H6O和C2H4O | C. | 麦芽糖和葡萄糖 | D. | 硬脂酸和软脂酸 |
19.X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素的周期序数之和为10,X、Y同主族,X的某种核素不含中子,Z的最外层电子数是电子层数的2倍,W在同周期中得电子能力最强,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Z>W | |
| C. | 单质的沸点:Z>W>X | |
| D. | X分别与Y、Z、W形成的化合物的化学键类型相同 |
20.已知反应: .如果要合成化合物A,其结构为:
.如果要合成化合物A,其结构为: ,下列说法正确的是( )
,下列说法正确的是( )
 .如果要合成化合物A,其结构为:
.如果要合成化合物A,其结构为: ,下列说法正确的是( )
,下列说法正确的是( )| A. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 | |
| B. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| C. | 该反应的原理是取代反应 | |
| D. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 |



