题目内容
6. 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
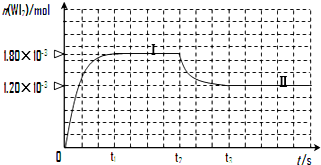
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)为模拟上述反应,在实验室中准确称取0.508g碘、0.736g金属钨放置于50.0mL密闭容器中,并加热使其反应.下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.
(1)该反应的化学平衡常数表达式为:K=$\frac{C(W{I}_{2})}{c({I}_{2})}$
(2)该反应是放热(填“放热”或“吸热”)反应,判断依据是温度升高,n(WI2)减小,平衡向左移动,所以是放热反应.
(3)反应从开始到t1(t1=3min)时间内的平均速率v(I2)=1.2×10-2mol/(L•min).
(4)能够说明上述反应已经达到平衡状态的有bc.
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化.
分析 (1)化学平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,WI2的物质的量减少,说明化学平衡逆向移动;
(3)从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$进行计算;
(4)A、达到平衡状态时,各物质的浓度不变,不一定相等;
B、单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明v逆=v正;
C、由于反应物中有气体,只有在平衡状态,密度不变;
D、因前后气体分子数相等,则无论是否达到平衡状态,压强不变.
解答 解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{C(W{I}_{2})}{c({I}_{2})}$,故答案为:$\frac{C(W{I}_{2})}{c({I}_{2})}$;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,WI2的物质的量减少,说明化学平衡逆向移动,因此正反应方向放热,
故答案为:放热;温度升高,n(WI2)减小,平衡向左移动,所以是放热反应;
(3)从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.8×1{0}^{-3}mol}{0.05L}}{3min}$=1.20×10-2 mol•L-1•min-1,
故答案为:1.20×10-2 mol•L-1•min-1;
(4)a、达到平衡状态时,各物质的浓度不变,不一定相等,故a错误;
b、单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明v逆=v正,故b正确;
c、由于反应物中有气体,只有在平衡状态,密度不变,故c正确;
d、因前后气体分子数相等,则无论是否达到平衡状态,压强不变,故d错误;
故选:bc.
点评 本题主要考查温度对化学平衡、化学平衡常数的影响以及平衡的判断,难度不大,考查学生分析和解决问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 向醋酸钠水溶液中通入少量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| B. | 向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O |
 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
| A. | (V1+V2+V3)L | B. | (V1+V2-V3)L | C. | (V1+V2-2V3)L | D. | V3-(V1+V2)L |
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
| A. | 合成塔的燃烧器内中心管道内通入氢气 | |
| B. | 应当控制氯气的用量少于氢气 | |
| C. | 氯气在氢气中燃烧,火焰为蓝色 | |
| D. | 反应需要点火才能进行,因此是一个吸热反应 |
 、
、
