题目内容
1.海水是人类的宝贵资源,从海水中可以提取多种化工原料.如下是某工厂对海水资源综合利用的示意图.
试回答下列问题.
(1)对精制氯化钠饱和溶液进行电解的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
(2)母液中有K+、Na+、Mg2+等阳离子.从示意图中可以看出,对母液进行一系列加工可制得金属镁.
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是使镁离子生成氢氧化镁沉淀.
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源、提高生产与经济效益的角度考虑,生产生石灰的主要原料是贝壳.
③电解无水氯化镁所得的镁蒸气在特定的环境里冷却即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是A(填选项字母).
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质.
①生成溴单质的化学反应的离子反应方程式是2Br-+Cl2═Br2+2Cl-;②以下是对生产溴单质所用的气态氧化剂寻找供货源的设想,其中合理的是CD(填选项字母).
a.从外地购买
b.当地建新厂
c.从本厂生产烧碱处循环
d.从本厂生产镁单质处循环.
分析 (1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠;
(2)①根据贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳,加入石灰乳沉淀镁离子,沉淀后过滤除去;
②根据贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳;
③根据不能和金属镁发生反应的气体来回答;
(3)①根据氯气能氧化溴离子得到氯离子和单质溴书写,氯气为氧化剂;
②生产烧碱时有氯气生成,生产镁时也有氯气生成.
解答 解:(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠,所以反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
(2)①贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳,加入石灰乳沉淀镁离子,使镁离子生成氢氧化镁沉淀,沉淀后过滤除去,
故答案为:使镁离子生成氢氧化镁沉淀;
②贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳,所以生产生石灰的主要原料是贝壳;
故答案为:贝壳;
③能和金属镁发生反应的气体:空气中氮气,生成氮化镁、氧气生成氧化镁、二氧化碳生成碳和氧化镁、水蒸气生成氢氧化镁和氢气,所以可以用氢气做镁蒸气的冷却剂,
故选:A;
(3)①氯气具有氧化性,氧化溴离子得到氯离子和单质溴,反应为:2Br-+Cl2═Br2+2Cl-,
故答案为:2Br-+Cl2═Br2+2Cl-;
②提取Br2,用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,是电解无水氯化镁,电解氯化镁的产物为镁和氯气,所以CD符合,
故答案为:CD.
点评 本题主要考查了海水制金属镁的过程以及原理,掌握实验的原理和操作方法结合流程图信息是解答本题的关键,题目难度中等.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
| A. | 不能发生消去反应 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能与4 mol H2反应 | |
| D. | 一定条件下,能发生取代反应 |
| A. | 物质的量浓度均为0.1 mol•L-1的下列四种物质的溶液:①NaAlO2,②CH3COONa,③NaHCO3,pH由大到小的顺序是①③② | |
| B. | 等pH的①(NH4)2SO4,②NH4HSO4、③NH4Cl,NH4+浓度由大到小的顺序是①③② | |
| C. | 等浓度的①NH4Al(SO4)2、②(NH4)2CO3、③(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是②③① | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①0.1 mol•L-1盐酸、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1硝酸银溶液中,Ag+浓度由大到小的顺序是③②① |
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 39g钾与足量氧气充分反应,转移的电子数一定是NA |
| A. | 质量数 | B. | 中子数 | C. | 核外电子数 | D. | 质子数 |
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是:
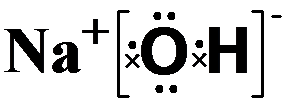 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.