题目内容
已知四种电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-.将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成; ②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收. 试回答下列问题:
(1)写出这四种物质的化学式:A ,B ,C ,D
(2)写出实验②中有关反应得化学方程式 .
①在A或D中滴入C,均有沉淀生成; ②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收. 试回答下列问题:
(1)写出这四种物质的化学式:A
(2)写出实验②中有关反应得化学方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:解答题目的关键是找到突破口.D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,以此解答该题.
解答:
解:(1)以上离子中可能生成的气体有NH3和CO2两种,由D和A、B反应生成,则D中含有CO32-和NH4+离子,应为(NH4)2CO3,在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,
故答案为:H2SO4;NaOH;Ba(NO3)2;(NH4)2CO3;
(2)D和B反应生成的气体为NH3,反应的方程式为;(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H20,能被H2SO4吸收,反应的离子方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H20,2NH3+H2SO4=(NH4)2SO4.
故答案为:H2SO4;NaOH;Ba(NO3)2;(NH4)2CO3;
(2)D和B反应生成的气体为NH3,反应的方程式为;(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H20,能被H2SO4吸收,反应的离子方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H20,2NH3+H2SO4=(NH4)2SO4.
点评:本题考查离子的检验和推断,题目难度中等,注意解答题目的关键是找到突破口,而本题的突破口为D和A、B都能生成气体.

练习册系列答案
相关题目
在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| B、甲酸能与水以任意比互溶 |
| C、10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D、甲酸的导电性比强酸溶液的导电性弱 |
下列说法正确的是( )
| A、加入Ba(NO3)2溶液生成白色沉淀,加入稀盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B、通入氯气后,溶液变黄色,加入淀粉溶液后变蓝,则原溶液中一定有I- |
| C、加入碳酸钠溶液有白色沉淀生成,再加入盐酸,沉淀消失,则原溶液中一定含有Ba2+ |
| D、加入氢氧化钠溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定有NH4+ |
下列关于胶体的叙述不正确的是( )
| A、红色激光束能透过小烧杯中的氢氧化铁胶体,但不能透过小烧杯中较浓的硫酸铜溶液 |
| B、胶体的丁达尔效应是胶体粒子对可见光散射而形成的 |
| C、胶体化学是随20世纪未纳米科技兴起而产生的 |
| D、纳米粒子的大小与胶体粒子相当,但纳米粒子的体系不一定是胶体 |
用惰性电极电解下列各稀溶液,经一段时间后,溶液的pH保持不变的是( )
| A、CuCl2 |
| B、NaCl溶液 |
| C、H2SO4溶液 |
| D、K2SO4溶液 |
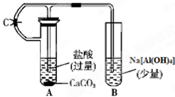 根据如图所示装置,请回答:
根据如图所示装置,请回答: