题目内容
3.下列有关实验的说法不正确的是( )| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
分析 A.标有温度的仪器有:滴定管、容量瓶、量筒、烧杯等;标有“0”刻度的仪器有:滴定管、托盘天平、温度计等;
B.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,NaOH促进重铬酸钾溶液水解;
C.中和热的测定中需要碱溶液过量;
D.在较高温度下溶解混合物形成浓溶液,再冷却热的浓溶液到一定温度,析出大量硝酸钾晶体.
解答 解:A.容量瓶、量筒和滴定管上都标有刻度,使用时避免热胀冷缩,所以标有使用温度,量筒“0”刻度就是底座、容量瓶只有最大容量的一个刻度,所以两者都无“0”刻度,使用时滴定管水洗后还需润洗,否则会导致溶液浓度偏低,但容量瓶水洗后不用润洗因还需加水定容,所以不润洗,否则易导致测定浓度偏大,故A正确;
B.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,NaOH促进重铬酸钾溶液水解,溶液颜色从橙色变成黄色,故B正确;
C.中和热的测定中需要碱溶液过量,使酸完全反应,碱的量是否过量未知,故C错误;
D.从含有少量氯化钾的硝酸钾溶液中提硝酸钾,应先在较高温度下溶解混合物形成浓溶液,再冷却热的浓溶液到一定温度,析出大量硝酸钾晶体,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、盐类水解、中和热的测定等知识点,明确实验原理、实验基本操作、物质性质是解本题关键,易错选项是A,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
15. C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
14.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显.
(1)写出铝与酸反应的离子方程式2Al+6H+=2Al3++3H2↑;
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:Cl-促进金属铝表面的氧化膜与H+反应;假设二:硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用.
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与酸反应的离子方程式2Al+6H+=2Al3++3H2↑;
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:Cl-促进金属铝表面的氧化膜与H+反应;假设二:硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用.
11.下列图与对应的叙述相符的是( )


| A. | 由图甲可知:H2的燃烧热为241.8kJ/mol | |
| B. | 由图乙可知:t0时刻改变的条件是增大压强或者升高温度 | |
| C. | 由图丙可知:将上述HX、HY、HZ溶液等体积混合,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度:c(Z-)>c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 由图丁可知:室温时M(OH)2(s)的溶度积常数为1.0×10-17 |
18.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |
8.下列命名正确的是( )
| A. | 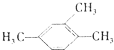 1,3,4-三甲苯 1,3,4-三甲苯 | B. | Cl-CH2-CH=CH2 3-氯-1-丙烯 | ||
| C. | 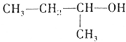 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 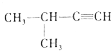 2-甲基-3-丁炔 2-甲基-3-丁炔 |
15.下列关于物质性质的比较,不正确的是( )
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 酸性强弱:HIO4>HBrO4>HClO4 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
13.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,而在地球上氦元素主要以${\;}_{2}^{4}$He的形式存在.关于23He和${\;}_{2}^{4}$He的叙述正确的是( )
| A. | 23He和24He互为同素异形体 | B. | 23He比24He少一个中子 | ||
| C. | 24He原子核内有4个中子 | D. | 23He和24He是同一种核素 |



