题目内容
14.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与酸反应的离子方程式2Al+6H+=2Al3++3H2↑;
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:Cl-促进金属铝表面的氧化膜与H+反应;假设二:硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用.
分析 (1)在金属活动顺序表中,铝排在氢的前面,铝与酸中的氢离子反应生成铝离子和氢气;
(2)温度越高反应速率越快,金属和酸的反应是放热反应;
(3)利用固定变量法探究氯离子和硫酸根离子对金属铝表面的氧化膜与H+反应的影响.
解答 解:(1)铝与酸反应生成铝离子和氢气,离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(2)反应1~15min内,铝与酸的反应是放出热量的,导致温度升高,使化学反应速率加快,
故答案为:反应放出热量,温度升高,使化学反应速率加快;
(3)在铝的表面有一层致密氧化铝薄膜,当加入盐酸和硫酸溶时,酸液首先与氧化铝薄膜反应,由反应的现象可知,铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应,比较盐酸和硫酸溶液中含有的离子的不同,出现这种现象的原因可能是:氯离子促进金属铝表面的氧化膜与H+反应,硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用,所以假设一:氯离子促进金属铝表面的氧化膜与H+反应;假设二:硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用;
故答案为:Cl-促进金属铝表面的氧化膜与H+反应;硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用.
点评 本题是一道实验探究题,考查了催化剂对化学反应速率的影响,解题的方法是:利用固定变量法设计实验论证假设,题目难度中等.

练习册系列答案
相关题目
6.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 除去甲烷中的乙烯用酸性高锰酸钾 | D. | 不能发生加聚反应 |
7.催化氧化的产物是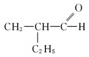 的醇是( )
的醇是( )
 的醇是( )
的醇是( )| A. | 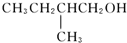 | B. | 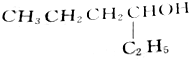 | ||
| C. | 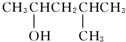 | D. | 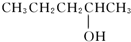 |
9.某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液
称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
根据上述各数据,计算待测烧碱溶液的浓度为0.4020mol•L-1,烧碱(40g/mol)的纯度为98.05%.
(4)下列操作,会导致实验结果偏低的是①②⑥(填序号);若把待测烧碱溶液放在滴定管中,则会导致实验结果偏低的是①④.
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式 管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来.
(1)配制待测液
称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
(4)下列操作,会导致实验结果偏低的是①②⑥(填序号);若把待测烧碱溶液放在滴定管中,则会导致实验结果偏低的是①④.
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式 管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来.
19.某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:
(1)写出铝片与盐酸、硫酸反应的离子方程式2Al+6H+=2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小.其原因是反应1~15min内,反应放出热量,温度升高,使化学反应速率加快;15~20min内,由于溶液中H+浓度降低,所以导致反应速率减小
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,SO42-对该反应不影响.
假设二:SO42对金属铝与H+反应没有影响.
假设三:SO42对金属铝与H+反应有抑制作用.
假设四:带低电荷的阴离子对金属铝与H+反应有促进作用.
请你以“假设一”为实验课题,设计实验方案探究,要求出主要实验步骤将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用.若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响.将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用.若速率减小,说明SO42对该反应有抑制作用;若速率不变,说明SO42对该反应的速率不影响.
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小.其原因是反应1~15min内,反应放出热量,温度升高,使化学反应速率加快;15~20min内,由于溶液中H+浓度降低,所以导致反应速率减小
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,SO42-对该反应不影响.
假设二:SO42对金属铝与H+反应没有影响.
假设三:SO42对金属铝与H+反应有抑制作用.
假设四:带低电荷的阴离子对金属铝与H+反应有促进作用.
请你以“假设一”为实验课题,设计实验方案探究,要求出主要实验步骤将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用.若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响.将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用.若速率减小,说明SO42对该反应有抑制作用;若速率不变,说明SO42对该反应的速率不影响.
3.下列有关实验的说法不正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
4.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ•mol-1)
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
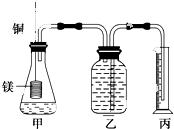 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下: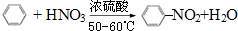 .
.