题目内容
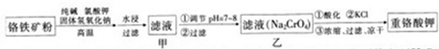
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
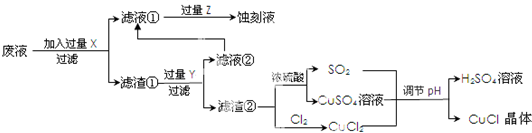
文字根据以上信息回答下列问题:
(1)写出生产过程中X Y (填化学式)
(2)写出产生CuCl的化学方程式 .
(3)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是 .
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是: .
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠50粒和10mL过量的FeCl3溶液250mL锥形瓶中,不断摇动;玻璃珠的作用是 .
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol?L-1硫酸铈标准溶液滴至绿色出现为终点.已知:CuCl+FeCl3══CuCl2+FeCl2、Fe2++Ce4+══Fe3++Ce3+.如此再重复二次测得:
④数据处理:计算得CuCl的纯度为 .(平行实验结果相差不能超过1%)

文字根据以上信息回答下列问题:
(1)写出生产过程中X
(2)写出产生CuCl的化学方程式
(3)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠50粒和10mL过量的FeCl3溶液250mL锥形瓶中,不断摇动;玻璃珠的作用是
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol?L-1硫酸铈标准溶液滴至绿色出现为终点.已知:CuCl+FeCl3══CuCl2+FeCl2、Fe2++Ce4+══Fe3++Ce3+.如此再重复二次测得:
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(3)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为:1:1;
(4)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(5)①玻璃珠在物质溶解过程中可以加速固体的溶解;
③依据方程式中各反应物量之间的关系计算CuCl的纯度.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(3)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为:1:1;
(4)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(5)①玻璃珠在物质溶解过程中可以加速固体的溶解;
③依据方程式中各反应物量之间的关系计算CuCl的纯度.
解答:
解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
故答案为:Fe;HCl;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(3)依据图示可知:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
故答案为:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
(5)①玻璃珠在物质溶解过程中可以加速固体的溶解;
故答案为:加速固体的溶解;
③根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为23.9×10-3L×0.1 mol?L-1×99.5g?mol-1/0.25g×100%=95%;
故答案为:95%;
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
故答案为:Fe;HCl;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(3)依据图示可知:Cu+2 H2SO4(浓)
| ||
故答案为:Cu+2 H2SO4(浓)
| ||
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
故答案为:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
(5)①玻璃珠在物质溶解过程中可以加速固体的溶解;
故答案为:加速固体的溶解;
③根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为23.9×10-3L×0.1 mol?L-1×99.5g?mol-1/0.25g×100%=95%;
故答案为:95%;
点评:本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,题目难度较大.

练习册系列答案
相关题目
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、淀粉溶液中:K+、NH4+、SO42-、I2 |
| B、浓氨水中:Na+、K+、Cl-、CO32- |
| C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、CO32-、SO32- |
| D、葡萄糖溶液中:Na+、H+、SO42-、Cr2O72-- |
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再滴入少量碱溶液调至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.则有关操作的原理或说法不符合的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化:2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
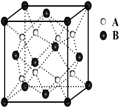 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
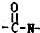 ,所以它属于二肽
,所以它属于二肽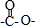 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验: