题目内容
1.关于钠元素的单质及其化合物的叙述中,不正确的是( )| A. | 钠是银白色、质软、熔点相对较低、密度比水小的金属单质 | |
| B. | 大量的钠着火时可以用沙子扑灭 | |
| C. | 金属钠在空气中长期放置,最终变为碳酸钠 | |
| D. | 过氧化钠是白色固体 |
分析 A.钠为银白色、质软、熔点低、密度较小的物质;
B.钠易和氧气、水反应,与二氧化硅不反应;
C.钠长期放置在空气中,发生一系列变化最终变为碳酸钠;
D.过氧化钠是淡黄色固体.
解答 解:A.钠为银白色,可以用小刀切割,在水中能熔化成小球,能浮在水面上,所以钠为银白色、质软、熔点低、密度较小的物质,故A正确;
B.钠易和氧气、水反应,和煤油不反应,且密度大于煤油,所以钠着火时可以用沙子盖灭,故B正确;
C.钠长期放置在空气中,先和氧气反应生成氧化钠、氧化钠和水反应生成氢氧化钠,氢氧化钠潮解,氢氧化钠溶液和二氧化碳反应生成十水碳酸钠,十水碳酸钠风化得到碳酸钠,所以钠发生一系列变化最终变为碳酸钠,故C正确;
D.过氧化钠是淡黄色固体,而不是白色固体,故D错误;
故选D.
点评 本题考查了钠及其氧化物的性质,明确物质的性质是解本题关键,再结合基本概念来分析解答,知道氧化钠、过氧化钠的区别,题目难度不大.

练习册系列答案
相关题目
20.2016年中国环境日的主题为“改善环境质量,推动绿色发展”,旨在保护环境造福人类.下列说法不正确的是( )
| A. | 通过指数造林,可吸收二氧化碳,降低温室效应 | |
| B. | 使用含硫量大幅减少的国V汽油可降低酸雨发生 | |
| C. | 开发新能源,减少使用化石燃料,可以减少雾霾的发生 | |
| D. | 汽车尾气经催化处理,可消除氮元素,避免光化学烟雾 |
1.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向某食盐溶液中滴加淀粉溶液,溶液颜色没有变为蓝色 | 不是加碘食盐 |
| B | 某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成 | 溶液中一定含有Cl- |
| C | 室温下,用pH试纸分别测0.100mol•L-1 CH3COONa溶液和0.100mol•L-1 Na2S溶液的pH,后者pH大 | 酸性:H2S<CH3COOH |
| D | 将气体X分别通入溴水和酸性高锰酸钾溶液,两溶液均褪色 | 气体X一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
18.通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是( )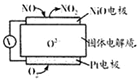

| A. | O2-向正极移动 | |
| B. | 负极的电极反应式为:NO-2e-+O2-═NO2 | |
| C. | O2的电极反应产物是H2O | |
| D. | 反应消耗的NO与O2的物质的量之比为l:2 |
5.20℃时,饱和NaCl溶液的密度为ρ g•cm-3,物质的量浓度为c mol•L-1,则下列说法中不正确的是( )
| A. | 20℃时,饱和NaCl溶液的溶解度:S=$\frac{5850c}{ρ-58.5}$g | |
| B. | 此溶液中NaCl的质量分数为:$\frac{58.5×c}{ρ×1000}$×100% | |
| C. | 20℃时,密度小于ρ g•cm-3的NaCl溶液是不饱和溶液 | |
| D. | 温度低于20℃时,饱和NaCl溶液的浓度小于cmol•L-1 |
6.已知H2O跟H+可结合成H3O+(称为水合氢离子),则H3O+中一定含有的化学键是( )
| A. | 离子键 | B. | 非极性键 | C. | 配位键 | D. | 氢键 |
13.下列说法或表示法错误的是( )
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
10.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物 氧化铁 FeO | B. | 非金属氧化物 二氧化硫 SO2 | ||
| C. | 酸 次氯酸 HClO3 | D. | 碱 纯碱 Na2CO3 |
11.如图是温度和压强对 X+Y?2Z反应影响示意图,下列叙述正确是( )
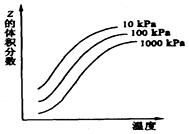

| A. | 正反应为放热 | |
| B. | 其他条件不变,升高温度,X和Y的转化率均降低 | |
| C. | X、Y、Z均为气态 | |
| D. | Z为气态,X和Y只有一种气态 |