题目内容
3.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )| A. | 2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
分析 硫酸在反应中表现为氧化性,应存在化合价的变化,S元素的化合价降低,又表现出酸性,应生成硫酸盐.
解答 解:A.2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,只表现为酸性,故A错误;
B.C和浓硫酸反应生成SO2、CO2和水,没有盐生成,只表现为氧化性,故B错误;
C.Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,浓硫酸表现酸性,没有表现出氧化性,故C错误;
D.FeO和H2SO4(浓)反应生成Fe2(SO4)3、SO2和水,S元素的化合价降低,浓硫酸表现为氧化性,生成Fe2(SO4)3,又表现为酸性,故D正确;
故选D.
点评 本题考查浓硫酸的性质,题目难度不大,注意氧化性和酸性的判断角度,为解答该题的关键,反应中元素化合价变化发生氧化还原反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )
| A. | FeS | B. | Fe3O4 | C. | FeCl3 | D. | FeCl2 |
18.下列表述正确的是( )
| A. | 次氯酸的电子式: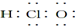 | B. | 14C的原子结构示意图: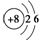 | ||
| C. | 188O2- 离子结构示意图: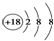 | D. | CO2的结构示为:O═C═O |
8.要将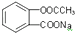 转化为
转化为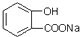 应选用的试剂和操作的是( )
应选用的试剂和操作的是( )
 转化为
转化为 应选用的试剂和操作的是( )
应选用的试剂和操作的是( )| A. | 加入足量的NaOH共热后,再通入足量的CO2 | |
| B. | 溶解,加热后通足量的CO2 | |
| C. | 与稀H2SO4共热后加足量的 NaOH | |
| D. | 与稀H2SO4共热后加足量的Na2CO3 |
12.下列物质的分子中,不含共价键的是( )
| A. | MgCl2 | B. | Cl2 | C. | HCl | D. | NaOH |
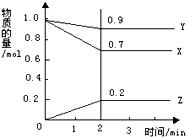 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).