题目内容
17.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
分析 A、工业上电解熔融Al2O3制备金属铝;
B、在海轮外壳上镶入锌块,金属锌是负极,金属铁是正极;
C、形成原电池可以加快金属的腐蚀速率;
D、电解MgCl2饱和溶液,得到氢氧化镁、氢气和氯气.
解答 解:A、工业上电解熔融Al2O3制备金属铝,故正确;
B、在海轮外壳上镶入锌块,金属锌是负极,金属铁是正极,可减缓船体的腐蚀速率,故正确;
C、改用粗锌可以形成原电池,可以加快金属锌和硫酸反应的速率,即粗锌比纯锌反应速率快,故正确;
D、电解熔融的MgCl2,得到氯化镁,电解MgCl2饱和溶液,可得到氢氧化镁、氢气和氯气,故D错误.
故选D.
点评 本题考查学生金属的冶炼、金属的腐蚀和防护知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列说法正确的是( )
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
5.下列说法中正确的是( )
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
12.将X、Y、Z三块金属分别用导线两两相连浸入稀H2SO4中组成原电池.X、Y相连时,X为负极;Z、Y相连时,电流由Y→Z;Z、X相连时,Z极上产生大量气泡.这三种金属的活动顺序正确的是( )
| A. | X>Z>Y | B. | Z>X>Y | C. | X>Y>Z | D. | Y>Z>X |
2.下列有关有机物说法正确的是( )
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 用酸性KMnO4溶液直接检验乙醇与浓硫酸反应的产物是否得到乙烯 | |
| C. | 用燃烧的方法可鉴别甲烷与乙炔 | |
| D. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 |
9.下列有关化学与生活的叙述不正确的是( )
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
6.下列有关性质的比较中,不正确的是( )
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: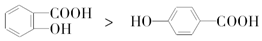 |
12.向含有1.17g NaCl和1.17g NaF的溶液中,加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥后称其质量为2.87g.根据此实验确定AgF在水中的溶解性应为( )
| A. | 易溶于水 | B. | 此AgCl更难溶于水 | ||
| C. | 与AgCl一样难溶于水 | D. | 无法确定溶解性 |