题目内容
12.将X、Y、Z三块金属分别用导线两两相连浸入稀H2SO4中组成原电池.X、Y相连时,X为负极;Z、Y相连时,电流由Y→Z;Z、X相连时,Z极上产生大量气泡.这三种金属的活动顺序正确的是( )| A. | X>Z>Y | B. | Z>X>Y | C. | X>Y>Z | D. | Y>Z>X |
分析 原电池中,较活泼的金属作负极,较不活泼的金属作正极,负极上失电子发生氧化反应,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极,据此分析解答.
解答 解:原电池中,较活泼的金属作负极,较不活泼的金属作正极,X、Y相连时,X为负极,则金属活动性顺序为X>Y;
电流从正极沿导线流向负极,Z、Y相连时,电流由Y→Z,则金属活动性顺序为Z>Y;
负极上失电子发生氧化反应,正极上氢离子得电子发生还原反应,X、Z相连时,Z极上产生大量气泡,则金属活动性顺序为X>Z;
则金属的活动性顺序是X>Z>Y.
故选A.
点评 本题以金属活动性顺序的判断为载体考查了原电池原理,根据金属的活泼性、电极反应类型、电极反应现象等知识来分析解答即可,难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
2.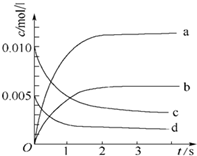 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)800℃时,反应达到平衡时,NO的物质的量浓度是0.0035mol/L.
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
3.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关说法不正确的是( )
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
7.下列说法正确的是( )
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
17.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
4.胶体分散系与其它分散系的本质差别是( )
| A. | 分散质直径大小 | B. | 分散质粒子是否带电 | ||
| C. | 是否稳定 | D. | 是否有丁达尔现象 |
1.用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A. | 1.6g 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L H2O中含有的分子的数目为0.5 NA |
