题目内容
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,4.48LCHCl3的分子数为0.2 NA | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
分析 A、标况下三氯甲烷为液态;
B、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
C、酯化反应为可逆反应;
D、C2H4和C3H6的最简式均为CH2.
解答 解:A、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、8g甲烷的物质的量为0.5mol,而甲烷中含10个电子,故0.5mol甲烷中含5NA个电子,故B正确;
C、酯化反应为可逆反应,不能进行彻底,故6g冰醋酸即0.1mol冰醋酸和4.6g乙醇即0.1mol乙醇不能完全反应得到0.1NA个乙酸乙酯分子,故C错误;
D、C2H4和C3H6的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,则含4NA个H原子,故D正确.
故选BD.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某饱和一元醛发生银镜反应时生成21.6克的银,若将等质量的该醛完全燃烧,生成二氧化碳体积为8.96L(标况下),则该醛是( )
| A. | 甲醛 | B. | 3-甲基丁醛 | C. | 已醛 | D. | 丁醛 |
1.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
8. 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用MnSO4对该反应有催化作用):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
该实验探究的是浓度和催化剂对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③>②>①(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是没有加入稀硫酸酸化或高锰酸钾过量导致.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用MnSO4对该反应有催化作用):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液和少量MnSO4 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是没有加入稀硫酸酸化或高锰酸钾过量导致.
18.下列说法正确的是( )
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
5.发明元素周期表的科学家是( )
| A. | 道尔顿 | B. | 牛顿 | C. | 门捷列夫 | D. | 爱迪生 |
2.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,1mol氦气含有原子数为2NA | |
| B. | 0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA | |
| C. | 常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
3.合成人造羊毛: 的单体正确的是( )
的单体正确的是( )
 的单体正确的是( )
的单体正确的是( )| A. |  | B. | CH3-CN | C. | CH2═CHCN | D. | CH2═HCN |
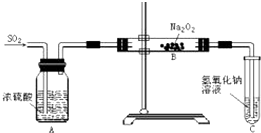 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.