题目内容
1.碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜.高温下这两种化合物均能分解成氧化铜.在高温下这两种化合物均能分解成氧化铜.溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是( )| A. | 35g | B. | 30g | C. | 20g | D. | 15g |
分析 根据Cu元素守恒n(CuO)=n(CuCl2),根据Cl原子守恒n(CuCl2)=$\frac{1}{2}$n(HCl),再根据m=nM计算CuO的质量.
解答 解:根据Cl原子守恒n(CuCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.5L×1mol/L=0.25mol,根据Cu元素守恒n(CuO)=n(CuCl2)=0.25mol,则得到CuO的质量为0.25mol×80g/mol=20,
故选:C.
点评 本题考查混合物计算,侧重考查学生分析计算能力,注意利用守恒法计算,避免过程的繁琐.

练习册系列答案
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | 偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 石灰水中加入少量小苏打:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ |
10.用1L1.0mol/LNaOH溶液吸收0.8molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
11.“封管实验”具有简易、方便、节约、绿色等优点,观察下列四幅图(夹持装置未画出),判断下列说法正确的是( )
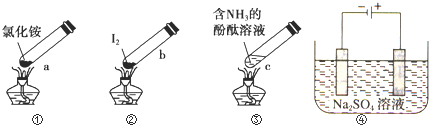

| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
 .
. .
. B.
B. 
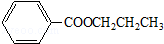
 .
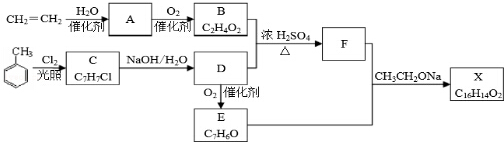
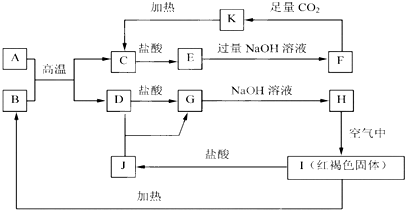
. .如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.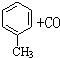 $→_{加热}^{AlCl_{3},HCl}$
$→_{加热}^{AlCl_{3},HCl}$ 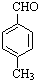 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$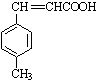 $→_{H_{2}SO_{4},加热}^{CH_{3}OH}$E
$→_{H_{2}SO_{4},加热}^{CH_{3}OH}$E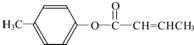 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为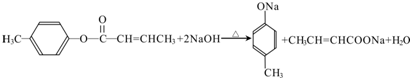 .
.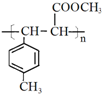 .
.
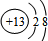 .
.