题目内容
4.某化学小组在实验室模拟高炉炼铁,其部分装置如图1:
请完成下列填空:
(1)利用甲酸与浓硫酸反应HCOOH$→_{△}^{浓硫酸}$CO↑+H2O制取CO,反应中浓硫酸的作用是催化剂、脱水剂和吸水剂.
(2)判断上述装置中CO与氧化铁发生反应的现象为红色粉末变为黑色,澄清石灰水变浑浊;该装置存在的缺陷是没有尾气处理装置,尾气中的CO能够污染空气.
(3)已知受热不均时,可发生副反应CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2FeO.为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管如图2,用橡皮管连接对应接口后,倒置盛稀硫酸的试管.
①样品和稀硫酸应分别置于甲、乙仪器中(填“甲”或“乙”),甲、乙试管中接口的连接方式为:A连接D,B连接E,C连接F(填各接口的编号).
②量气管可以用化学实验室中一种常用仪器来改装,该仪器的名称是碱式滴定管.当气体不再产生且恢复至室温时,如丙图所示量气管读数20.70mL.若量气之前的其他操作均正确,根据该读数并将产生的气体体积换算为标准状况后,所计算样品中铁的质量分数将偏小(填“偏大”、“偏小”或“无影响”),原因是读数时量气管液面高于左侧液面,气体受到的压强增大,导致所测气体体积偏小(若无影响该空不必作答).
分析 (1)由方程式HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,知反应生成了CO、H2O,从反应物、产物、能否促进反应向正反应方向进行来考虑浓硫酸的作用;
(2)由方程式3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$3CO2+2Fe描述实验现象;CO是有毒气体顾不能直接排放到空气中;
(3)①装置连接图,将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积;
②仪器识别、量气管读数注意精确到0.01ml、误差分析俯视时偏小.
解答 解:(1)由方程式HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,知反应生成了CO、H2O要想得到干燥的CO必须要除去H2O故其作用是吸水剂,又因为生成物中有水生成,因此浓硫酸吸水可以促进反应不断的向正反应方向进行,故又为催化剂,浓硫酸又能将HCOOH物质中的H、O按照2:1比例进行脱去,形成水故又为脱水剂;
故答案为:催化剂、脱水剂和吸水剂;
(2)该装置发生反应为3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$3CO2+2Fe,Fe2O3本身为红棕色Fe为黑色顾现象为红色粉末变为黑色,且反应生成了CO2,澄清石灰水变浑浊,所以现象为红色粉末变为黑色,澄清石灰水变浑浊;产生的CO是有毒的气体不能直接排放到空气中故缺陷是没有尾气处理装置,尾气中的CO能够污染空气,
故答案为:红色粉末变为黑色,澄清石灰水变浑浊;没有尾气处理装置,尾气中的CO能够污染空气;
(3)①因为副反应CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2FeO为测定所得其中黑色产物中铁的含量,黑色产物Fe、FeO为固体、溶解物质稀硫酸为液体,所以该实验装置为固+液的反应,所以应置于甲、乙装置中;(2)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积,
故答案为:甲、乙;D、E;
②仪器识别题,顾该仪器的名称是碱式滴定管;待左右液面齐时读数,注意精确到0.01ml,故为20.70ml;待装置内外气压相等,读数前应上下移动滴定管,使左右两边液面相平,读数时由于量气管液面高于左侧液面,因此气体受到的压强增大,导致所测气体体积偏小,则测得的氢气体积较小,相当于物质的量减小,间接导致测得的铁的物质的量减小,所以铁的含量偏小.
故答案为:碱式滴定管;20.70ml;偏小;读数时量气管液面高于左侧液面,气体受到的压强增大,导致所测气体体积偏小.
点评 本题难度不大,掌握浓硫酸的作用,以及CO还原Fe2O3原理中的实验现象,以及对有毒气体CO处理方法,以及读取液滴体积时不正确的读数方式带来的实验误差分析等.

 53随堂测系列答案
53随堂测系列答案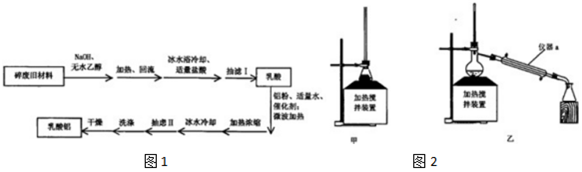
己知:①反应原理:
 $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂.
请回答:
(1)聚乳酸与NaOH加热回流合适的装置是图2甲中的甲,图2乙仪器a的名称冷凝管.
(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据.根据实验1-3,最合适的?(乳酸)为0.20.根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多.
| 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) |
| 1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
| 2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
| 3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液.
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol•L-1的EDTA溶液.然后加入指示剂,用d mol•L-1的标准锌溶液滴定过量的EDTA溶液.Al3+和Zn2+与EDTA均1:1反应.实验消耗标准锌溶液 emL,则乳酸铝纯度为$\frac{29.4(bc-de)}{a}%$.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ②③④ | D. | 全部 |
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1mol•L-1的CH3COOH溶液中,由水电离的c(H+)为1×10-13mol•L-1 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7 | |
| D. | 等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2 |
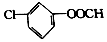 有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )
有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
| A. | 物质的量就是物质的数量 | |
| B. | 物质的量就是物质的摩尔质量 | |
| C. | 物质的量就是物质所含微粒数目的多少 | |
| D. | 物质的量是一种基本物理量 |
| 选项 | 离子方程式 | 评价 |
| A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应Ba2++HCO3 -+OH-═BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
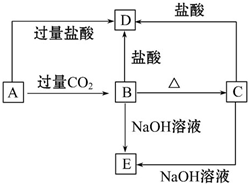 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.