题目内容
19.A、B、C、D四种可溶性物质,都是由下表中的离子形成的.| 阳离子 | Ba2+ | Ag+ | Na+ | Cu2+ |
| 阴离子 | NO3- | SO42- | OH- | CO32- |
①若把四种物质分别溶解于盛有蒸馏水的四支试管中,只有C溶液呈蓝色.
②若向①的四支试管中分别加盐酸,B溶液有沉淀产生,D溶液有无色无味的气体逸出.
(1)根据①②实验事实可推断它们的化学式为:
ABa(OH)2,BAgNO3,CCuSO4,DNa2CO3.
(2)写出下列反应的离子方程式:
a.A溶液与C溶液混合:Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓
b.向A溶液中加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++SO42-+OH-+H+=H2O+BaSO4↓.
分析 ①若把四种物质分别溶解于盛有蒸馏水的四支试管中,只有C溶液呈蓝色,说明C中含有Cu2+,
②若向①的四支试管中分别加盐酸,B溶液有沉淀产生说明是AgCl沉淀,则B中含有Ag+,依据离子共存可知,B为AgNO3,D溶液有无色无味的气体逸出说明D中含CO32-,依据离子共存判断D只能是Na2CO3,C为CuSO4,A为Ba(OH)2,
解答 解:A、B、C、D四种可溶性物质,都是由下表中的离子形成的,每种物质中阴阳离子互不重复,
①若把四种物质分别溶解于盛有蒸馏水的四支试管中,只有C溶液呈蓝色,说明C中含有Cu2+,
②若向①的四支试管中分别加盐酸,B溶液有沉淀产生说明是AgCl沉淀,则B中含有Ag+,依据离子共存可知,B为AgNO3,D溶液有无色无味的气体逸出说明D中含CO32-,依据离子共存判断D只能是Na2CO3,C为CuSO4,A为Ba(OH)2,
(1)根据①②实验事实可推断它们的化学式为:A为Ba(OH)2,B为AgNO3,C为CuSO4,D为Na2CO3,
BCD,
故答案为:Ba(OH)2,AgNO3,CuSO4,Na2CO3;
(2)a.A溶液与C溶液混合生成硫酸钡白色沉淀和氢氧化铜沉淀,反应的离子方程式为:Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,
故答案为:Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓;
b.向A溶液中加入NaHSO4溶液至Ba2+恰好沉淀完全,Ba(OH)2和NaHSO4按照1:1反应,反应的离子方程式为:Ba2++SO42-+OH-+H+=H2O+BaSO4↓,
故答案为:Ba2++SO42-+OH-+H+=H2O+BaSO4↓;
点评 本题考查了离子检验,离子共存,离子性质的理解应用,主要是依据反应现象判断存在的离子得到物质组成,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.35mol | B. | 0.45 mol | C. | 0.50 mol | D. | 1.00mol |
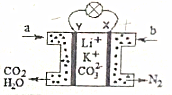 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
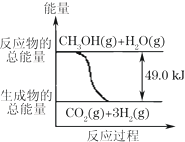 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
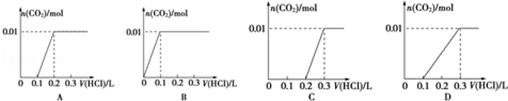
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;
(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
| A. | NaHCO3 | B. | NaOH | C. | HNO3 | D. | Cu |
| A. | 过滤时用玻璃棒搅拌漏斗里的液体 | |
| B. | 加热后的蒸发皿用坩埚钳夹取 | |
| C. | 用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
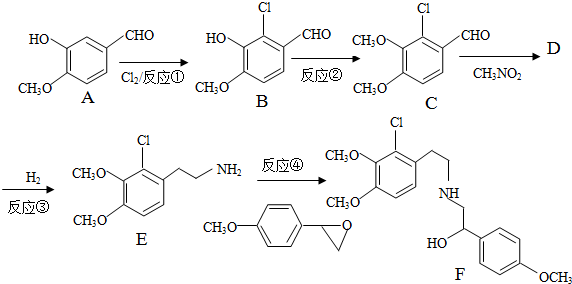
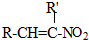 +H2O
+H2O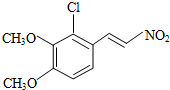 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E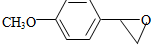 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式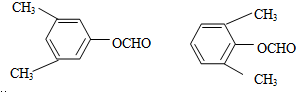 .
.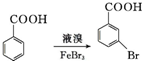 .写出以
.写出以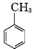 为原料制备
为原料制备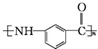 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)