题目内容
8.有A、B、C、D四种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;D原子最外层有1个单电子,其次外层有3个能级且均排满电子,则:(1)每摩尔B元素的氢化物晶体中存在氢键数目为2NA.
(2)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为HF>H2O>NH3 (用化学式表示).
(3)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3.
(4)A的单质中σ键的个数为1,π键的个数为2.
(5)写出基态D原子的价电子排布式:3d104s1.
分析 有A、B、C、D、五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,所以C是F元素,则B是O元素;D原子最外层有1个单电子,其次外层有3个能级且均排满电子,D为铜元素.
解答 解:有A、B、C、D、五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,所以C是F元素,则B是O元素;D原子最外层有1个单电子,其次外层有3个能级且均排满电子,D为铜元素,
(1)B是O元素,氢化物为水,则冰中每个水分子周围只有4个紧邻的水分子,故1molH2O中含有2mol氢键,氢键数目为2NA,故答案为:2NA;
(2)A、B、C 三种元素为N、O、F,非金属性F>O>N,非金属性越强,氢化物稳定性越强,故答案为:HF>H2O>NH3;
(3)A的最简单氢化物为NH3,NH3分子中氮原子价层电子对=3+1=4,且含有一个孤电子对,所以分子空间构型是三角锥型,采取sp3杂化,
故答案为:三角锥型;sp3;
(4)A为N,氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,故答案为:1;2;
(5)D为铜,根据构造原理知,其基态原子的电子排布式[Ar]3d104s1;价电子排布式为3d104s1,故答案为:3d104s1.
点评 本题涉及分子空间构型的判断、杂化方式的判断、第一电离能的判断等知识点,这些都是考试热点,注意第一电离能的变化趋势及异常现象,为易错点.

练习册系列答案
相关题目
19.对下列流程有关判断正确的是( )
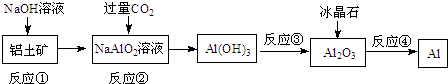

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
16.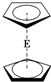 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为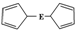 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为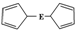 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
20.取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份.其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
17.下列离子方程式的书写正确的是( )
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: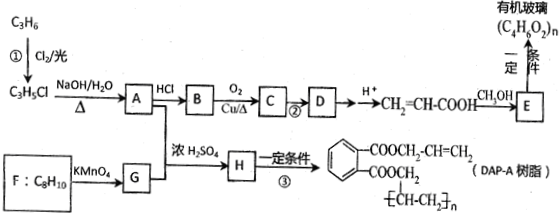
 ;
; ;
;
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.