题目内容
20.在FeCl3和CuCl2的混合溶液中投入Fe,充分反应后,溶液中所含阳离子不可能出现的情况是(不考虑水电离出的H+)( )| A. | 只含Fe2+ | B. | 只含Cu2+、Fe2+ | ||
| C. | 只含Fe3+、Fe2+ | D. | 只含Fe3+、Cu2+、Fe2+ |
分析 Fe3+、Cu2+的氧化性强弱为Fe3+>Cu2+,Fe3+优先反应,固体有剩余,则反应后的溶液中一定不存在Fe3+;若剩余固体只有Cu,则反应后的溶液中一定Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有Fe剩余,一定有铜生成,Fe3+和Cu2+无剩余,以此来解答.
解答 解:A.当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+,只含Fe2+,故A正确;
B.当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+,溶液中可以只含只含Cu2+、Fe2+,故B正确;
C.溶液中离子氧化性,Fe3+>Cu2+>Fe2+,在FeCl3和CuCl2的混合溶液中投入Fe,2Fe3++Fe=3Fe2+,有Fe3+存在一定存在Cu2+>Fe2,故C错误;
D.溶液中离子氧化性,Fe3+>Cu2+>Fe2+,加入的铁粉少量时,铁离子部分反应,溶液中可以存在Fe3+、Cu2+、Fe2+,故D正确;
故选C.
点评 本题考查铁的化学性质,为高频考点,侧重元素化合物性质及氧化还原反应的考查,注意Fe3+、Cu2+的氧化性强弱及固体的成分判断是解本题的关键,熟悉铁离子与金属铜、铁反应的化学方程式,题目难度中等.

练习册系列答案
相关题目
10.已知0.1mol L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2A、NaHA两溶液中,都含有5种离子,且种类相同 | |
| B. | HA-水解的离子方程式为:HA-+H2O?H3O++A2- | |
| C. | 在NaHA溶液中一定有:c(OH-)=c(HA-)+2c(H2A)+c(H+)-c(Na+) | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
11.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
8.常温下,对 pH=10 的 NaHCO3 溶液中,各微粒的物质的量浓度分析正确的是( )
| A. | c(CO32-)>c(H2CO3) | B. | c(Na +)>c(HCO3-)>c(H +)>c(OH -) | ||
| C. | c(Na+)+c(H+)═c(HCO3-)+c(CO 32-)+c(OH-) | D. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3 ) |
15.已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系.下列说法错误的是( )
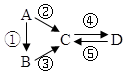

| A. | 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染.则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO | |
| B. | 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,则它们之间的关系为△H 2=△H1+△H 3 | |
| C. | 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑ | |
| D. | 若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
12.下列有关离子方程式的书写正确的是( )
| A. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| B. | 在标准状况下,17.92L SO2气体通入到1L 1mol/L的NaOH溶液中:4SO2+5OH-═SO32-+3HSO3-+H2O | |
| C. | 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 用KI-淀粉试纸和食醋检验食用盐是否为加碘食盐:IO3-+5I-+6H+═3I2+3H2O |
17.我国科学家近期研究发现.NaHCO3可显著结合癌细胞中乳酸电离出的H+,从而间接地“饿死”癌细胞,下列说法中不正确的是( )
| A. | NaHCO3为弱电解质 | B. | H2CO3的酸性弱于乳酸 | ||
| C. | NaHCO3也可以用来治疗胃酸过多 | D. | NaHCO3固体中含有离子键和共价键 |
18.1mol/L的Na2SO4溶液是( )
| A. | 溶液中含有1mol Na2SO4 | |
| B. | 1L水中加入142g Na2SO4 | |
| C. | 1mol Na2SO4溶于1mol水中 | |
| D. | 将1mol Na2SO4溶于水后配成1L溶液 |