题目内容
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种.
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有D盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加盐酸,A盐溶液有沉淀产生,B盐溶液有无色无味气体逸出.
根据(1)(2)实验事实可推断它们的化学式为:
A. ;B. ;C. ;D. .
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有D盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加盐酸,A盐溶液有沉淀产生,B盐溶液有无色无味气体逸出.
根据(1)(2)实验事实可推断它们的化学式为:
A.
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:给出八种离子,形成四种可溶性物质,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定.如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
解答:
解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
①中由于D盐是蓝色的,所以D为CuSO4;
②四支试管加入盐酸,A有沉淀,则A溶液为AgNO3;而B生成无色气体,则为二氧化碳,即B为Na2CO3.
综上所述:A为AgNO3;B为Na2CO3;C为BaCl2;D为CuSO4;
故答案为:AgNO3;Na2CO3;BaCl2;CuSO4.
①中由于D盐是蓝色的,所以D为CuSO4;
②四支试管加入盐酸,A有沉淀,则A溶液为AgNO3;而B生成无色气体,则为二氧化碳,即B为Na2CO3.
综上所述:A为AgNO3;B为Na2CO3;C为BaCl2;D为CuSO4;
故答案为:AgNO3;Na2CO3;BaCl2;CuSO4.
点评:本题考查了离子性质的应用,离子共存的判断,物质性质的分析应用,阴阳离子的特征反应现象是判断的依据和解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
设NA表示阿伏加德罗常数的值,下列关于0.2mol/L Ba(NO3)2溶液的叙述不正确的是( )
| A、2 L溶液中阴阳离子总数为1.2NA |
| B、500 mL溶液中NO3-浓度为0.2 mol/L |
| C、500 mL溶液中Ba2+浓度为0.2 mol/L |
| D、500 mL溶液中NO3-物质的量为0.2 mol |
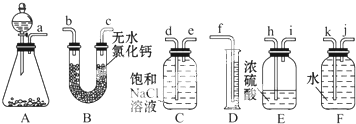
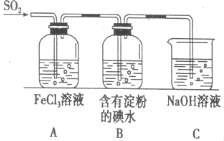 SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: